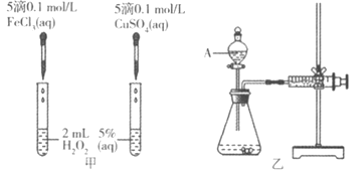
��Ŀ����
����Ŀ����֪��H2(g)��I2(g) ![]() 2HI(g) H����149kJ/mol���ڼס������������ͬ���ܱ������г��뷴Ӧ����ֺ��º��ݣ�����ʼŨ�����±���ʾ��
2HI(g) H����149kJ/mol���ڼס������������ͬ���ܱ������г��뷴Ӧ����ֺ��º��ݣ�����ʼŨ�����±���ʾ��
��ʼ Ũ�� | c(H2)(mol/L) | c(I2)(mol/L) | c(HI)/(mol/L) |
�� | 0.01 | 0.01 | 0 |
�� | 0.02 | 0.02 | 0 |
���з�Ӧ�ﵽƽ��ʱ�����c(H2)��0.008 mol/L�����ж���ȷ����( )
A.ƽ��ʱ������H2��ת�����Ǽ��е�2��
B.ƽ��ʱ�����л�������ɫ��������
C.ƽ��ʱ���ס����������ı仯ֵ���
D.���¶��£���Ӧ��ƽ�ⳣ��K��0.25
���𰸡�D
��������
A���÷�Ӧǰ�������������䣬���е�Ũ��Ϊ���е�2��������ѹǿΪ����2��������ѹǿ��ƽ�ⲻ�ƶ�������Ϊ��Чƽ�⣬ƽ��ʱ��Ӧ����ֵ�ת������ͬ����A����
B������Ϊ��Чƽ�⣬ƽ��ʱ����c(I2)�Ǽ��е�2����ƽ��ʱ������ɫ�����B����
C������Ϊ��Чƽ�⣬��Ӧ��ת������ͬ�����вμӷ�ӦI2���Ǽ��е�2�������е������仯�Ǽ��е�2������C����
D������ƽ��ʱ������Ũ��Ϊ0.008mol/L����
H2(g) + I2(g) 2HI(g)
��ʼ(mol/L)�� 0.01 0.01 0
�仯(mol/L)��0.002 0.002 0.004
ƽ��(mol/L)��0.008 0.008 0.004
�ʸ��¶��¸÷�Ӧ��ƽ�ⳣ��K=![]() =0.25����D��ȷ��
=0.25����D��ȷ��
��ѡD��

����Ŀ������ʵ������������ܵó���ȷ���۵���![]()
![]()
ѡ�� | ʵ����� | ���� | ���� |
A | ����� | ��Һ���� | �ﵽ�ζ��յ� |
B | �� | Ʒ����Һ��ɫ����ɫ |
|
C | ��Ũ�Ⱦ�Ϊ | �Ȳ������ɫ���� | ��ͬ�¶��£� |
D | �ʹ�����Һ��ͨ�� | ������ɫ���� | С�մ����������� |
A.AB.BC.CD.D