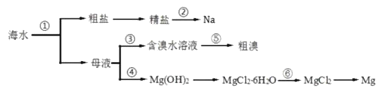
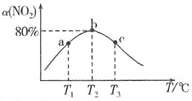
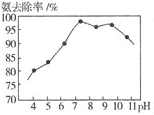
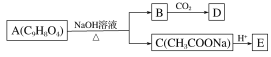
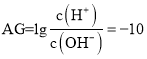题目内容
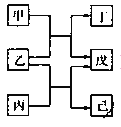
【题目】X、Y、Z、M 均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法中不正确的是( )
![]()
A.若 M 是单质铁,则 Z 溶液可能是 FeCl2 溶液
B.若 M 是氢氧化钠,则 X 水溶液呈酸性
C.若 M 是氧气,则 X、Z 的相对分子质量可能相差 48
D.若 M 是强氧化性的单质,则 X 可能是金属铝
【答案】D
【解析】
A. 若 M 是单质铁,Z是FeCl2,则Y必是FeCl3,发生的化学反应是2Fe+3Cl2![]() 2FeCl3,则X是氯气,符合题干要求,故A正确;
2FeCl3,则X是氯气,符合题干要求,故A正确;
B. 若 M 是氢氧化钠,说明X能连续与氢氧化钠反应,即Y应是氢氧化物,Y能与氢氧化钠继续反应,说明氢氧化物Y具有两性,则Y是氢氧化铝,X必是含有Al3+的溶液,Al3+水解使溶液呈酸性,故B正确;
C. 若 M 是氧气,则X应是能被氧气连续氧化的物质,即一般情况Y和Z都是氧化物,若X是硫,Y是SO2,Z是SO3,则 X、Z 的相对分子质量可能相差 48,故C正确;
D. 若 M 是强氧化性的单质,则X应为有可变价态的元素的物质,所以不可能是金属铝,因为铝没有可变价,故D错误;
故选D。

【题目】下列说法正确的是(________)
A.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
C.由“C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1”可知,金刚石比石墨稳定
D.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
E.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
F.测定盐酸和氢氧化钠反应的中和热实验中,所用试剂可以是浓溶液
G.1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO3
H.把铝条放入盛有过量稀盐酸的试管中,加入Na2SO4溶液不影响氢气产生速率
I.对于可逆反应,反应进行的净速率是正、逆反应速率之差
J.对于可逆反应,正、逆反应速率的比值是恒定的
K.探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合
L.已知:
共价键 | C-C | C=C | C-H | H-H |
键能/kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g)的ΔH为-384kJ·mol-1
(g)的ΔH为-384kJ·mol-1