题目内容
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
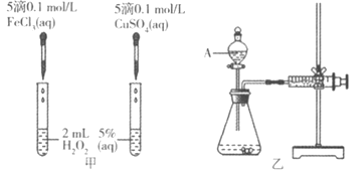
(1)定性如图甲可通过观察________________现象,定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是________________
(2)定量如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为________________,实验中需要测量的数是________________
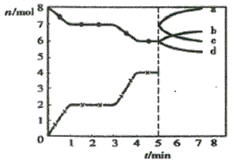
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。A、B、C、D各点反应速率由快到慢的顺序为________。
【答案】单位时间内产生气泡的快慢 消除阴离子不同对实验的干扰 分液漏斗 产生40mL气体所需的时间 D>C>B>A
【解析】
(1)过氧化氢分解会放出氧气,比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排除阴离子的干扰;
(2)根据常用的仪器名称分析,该反应是通过反应速率分析的,所以根据v=![]() 分析;
分析;
(3)根据v=![]() ,结合图像比较反应速率快慢。
,结合图像比较反应速率快慢。
(1)定性比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过观察产生气泡的快慢来比较,产生气泡快的,催化效果好;在探究Fe3+和Cu2+对H2O2分解的催化效果时,必须保持其他的条件完全相同,所以将CuSO4改为CuCl2更为合理,可以避免由于阴离子不同造成的干扰,故答案为:单位时间内产生气泡的快慢;消除阴离子不同对实验的干扰;
(2)A仪器是有活塞能控制滴加速率的漏斗,名称是分液漏斗;实验时均以生成40mL气体为准,根据v=![]() ,还需要测定产生40mL气体所需的时间,故答案为:分液漏斗;产生40mL气体所需的时间;
,还需要测定产生40mL气体所需的时间,故答案为:分液漏斗;产生40mL气体所需的时间;
(3)根据图象结合v=![]() 知,图像中各点的斜率越大,反应速率越快,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,故答案为:D>C>B>A。
知,图像中各点的斜率越大,反应速率越快,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,故答案为:D>C>B>A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知:H2(g)+I2(g) ![]() 2HI(g) H=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
2HI(g) H=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
起始 浓度 | c(H2)(mol/L) | c(I2)(mol/L) | c(HI)/(mol/L) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
甲中反应达到平衡时,测得c(H2)=0.008 mol/L下列判断正确的是( )
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(S)+2NO(g)+Cl2(g) K2
2NaNO3(S)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=________________;
(2)已知几种化学键的键能数据如下表(NO分子中氮氧键键能为630 kJ/mol,亚硝酸氯的结构为Cl-N=O):
化学键 | N | Cl-Cl | Cl-N | N=O |
键能/kJmol-1 | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g) ![]() 2ClNO(g)反应的△H3和a的关系为△H3=________;
2ClNO(g)反应的△H3和a的关系为△H3=________;
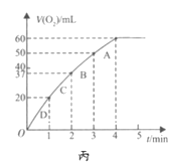
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl(g),在不同温度下测得c(ClNO)与时间的关系如图A:
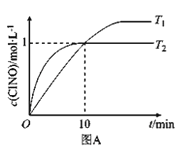
①由图A可判断T1________T2,该反应的△H________0(填“>”“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=________;
③T2时该反应的平衡常数K=____________;
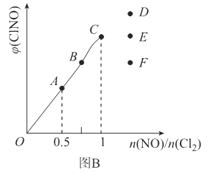
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化如图B,则A、B、C三状态中,NO的转化率最大的是________点。