题目内容
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是
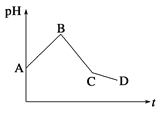
A.阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2
B.AB段阳极只产生Cl2,阴极只产生Cu
C.BC段表示在阴极上是H+放电产生了H2
D.CD段相当于电解水
【答案】C
【解析】
试题分析:由于两种溶液的体积相等,物质的量浓度也相等,即溶质的物质的量相等,设CuSO4和NaCl的物质的量各1 mol,电解分3个阶段:阳极:氢氧根离子失电子,阴极:氢离子得电子,它们都来源于水的电离,实质是电解水,导致溶液的体积减小,使溶液中氢离子浓度增大,pH继续减小;A.根据离子放电顺序知,阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2,故A正确;B.阳极上氯离子先放电、阴极上铜离子先放电,当电解氯化铜时,溶液pH增大,所以AB段阳极只产生Cl2,阴极只产生Cu,故B正确;C.BC段阴极上铜离子放电生成铜,故C错误;D.CD段是第三阶段,阳极上氢氧根离子放电、阴极上氢离子放电,所以相当于电解水,故D正确;故选C。

练习册系列答案
相关题目