题目内容
【题目】科学家制造出一种使用固态电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作为惰性电极,在电极上分别通入CH4和空气,其中固态电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(O2+4e-=2O2-)。
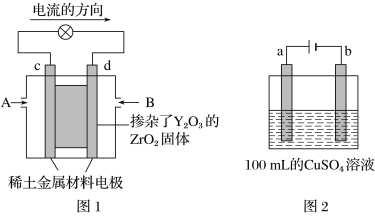
(1)c电极的名称为________(填“正极”或“负极”),d电极上的电极反应式为: ____。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为: __________,若a电极产生56 mL(标准状况)气体,则所得溶液的c(H+)=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
【答案】正极 CH4+4O2--8e-=CO2+2H2O 4OH--4e-=2H2O+O2↑ 0.1 mol·L-1 ac
【解析】
(1)依据装置图中电流流向分析,c为正极,氧气得电子发生还原反应,d为负极,甲烷失电子发生氧化反应;
(2)图2是电解池,与电源正极连接的a电极为阳极,发生4OH--4e-=O2↑+2H2O,b为阴极,发生为Cu2++2e-=Cu,结合电极方程式计算,使溶液恢复的方法是加入两个电极产物反应后得到的物质。
(1)图1是原电池,依据电流流向是从正极流向负极,c电极为正极,氧气得到电子发生还原反应,d电极为电池负极,甲烷失电子发生还原反应,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子,负极电极反应为:CH4+4O2--8e-=CO2+2H2O;
(2)如图2所示电解100mL0.5mol/LCuSO4溶液,发生的电解池反应为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中OH-失去电子发生氧化反应,电极反应为:4OH--4e-=2H2O+O2↑;
2Cu+O2↑+2H2SO4,与电源正极相连的为阳极,溶液中OH-失去电子发生氧化反应,电极反应为:4OH--4e-=2H2O+O2↑;
若a电极产生56mL(标准状况)气体为O2,其物质的量n(O2)=0.056L÷22.4L/mol=0.0025mol,消耗OH-离子的物质的量为n(OH-)=4n(O2)=0.01mol,则溶液中生成H+物质的量n(H+)= n(OH-)=0.01mol,c(H+)=![]() =0.1mol/L;
=0.1mol/L;
在所得溶液电解过程中,CuSO4溶液每反应产生2个Cu原子,就会同时损失2个O原子,相当于失去2个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,因为CuCO3+H2SO4=CuSO4+CO2↑+H2O,相当于加CuO,符合恢复溶液浓度的定量关系;但不能加入Cu(OH)2、Cu2(OH)2CO3,而Cu(OH)2+H2SO4=CuSO4+2H2O、Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O,除增加溶质外还增加了水,故合理选项是ac。

 阅读快车系列答案
阅读快车系列答案【题目】汽车尾气脱硝脱碳的主要原理为2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。在一定温度下,体积固定为2L的密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表所示:
时间/s | c(NO)/(mol·L-1) | c(CO)/(mol·L-1) |
0 | 9.50×10-3 | 9.00×10-3 |
1 | 4.50×10-3 | 4.00×10-3 |
2 | 2.50×10-3 | 2.00×10-3 |
3 | 1.50×10-3 | 1.00×10-3 |
4 | 1.50×10-3 | 1.00×10-3 |
下列说法正确的是
A.前2 s内的平均反应速率v(N2)=3.5×10-3mol·L-1·s-1
B.升高温度时,逆反应速率增大,正反应速率减小
C.容器内气体压强不再发生变化时,反应达到平衡状态
D.容器中气体的浓度c(NO):c(CO):c(N2):c(CO2)=2:2:1:2时,反应达到平衡状态