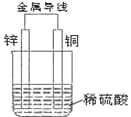
题目内容
【题目】二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为MnCO3)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
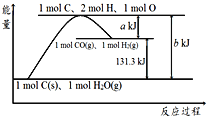
i.MnCO3(s)MnO(s)+CO2(g) △H1=+a kJmol1
ii.2MnO(s)+O2(g)2MnO2(s) △H2=+b kJmol1
①反应i的化学平衡常数表达式K=_______;
②焙烧MnCO3制取MnO2的热化学方程式是_________;
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是_______;

(3)在其他条件不变时,某科研团队对影响转化率的生产条件进行了研究,结果如图2、图3所示。
①常压下,要提高MnCO3的转化率,应选择的生产条件是____________焙烧6![]() 8h。
8h。
②图3中,焙烧8h时,MnCO3的转化率:干空气<湿空气,原因是______________。
【答案】c(CO2) 2MnCO3(s) +O2(g) ![]() 2MnO2(s) +2CO2(g) △H1=+(2a+b) kJmol1 保持O2的浓度,降低CO2的浓度,使平衡正向移动,提高碳酸锰的转化率 湿空气中,350℃左右 干空气中没有催化剂,反应速率比湿空气中慢,8h时未达到平衡
2MnO2(s) +2CO2(g) △H1=+(2a+b) kJmol1 保持O2的浓度,降低CO2的浓度,使平衡正向移动,提高碳酸锰的转化率 湿空气中,350℃左右 干空气中没有催化剂,反应速率比湿空气中慢,8h时未达到平衡
【解析】
(1)①根据化学平衡常数的定义来书写;②将第i方程式乘以2,再加上第ii个方程式得到焙烧MnCO3制取MnO2的热化学方程式。
(2)焙烧(装置如图1)时持续通入空气,并不断抽气主要利用平衡移动原理分析。
(3)①根据图中的信息得出;②根据湿空气中会吸收部分的二氧化碳及平衡移动来分析。
(1)①反应i的化学平衡常数表达式是生成物浓度的系数次方之积除以反应物浓度的系数次方之积,因此K= c(CO2);故答案为:c(CO2)。
②将第i方程式乘以2,再加上第ii个方程式得到焙烧MnCO3制取MnO2的热化学方程式是2MnCO3(s) +O2(g) ![]() 2MnO2(s) +2CO2(g) △H1=+(2a+b) kJmol1;故答案为:2MnCO3(s) +O2(g)
2MnO2(s) +2CO2(g) △H1=+(2a+b) kJmol1;故答案为:2MnCO3(s) +O2(g) ![]() 2MnO2(s) +2CO2(g) △H1=+(2a+b) kJmol1。
2MnO2(s) +2CO2(g) △H1=+(2a+b) kJmol1。
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是不断的移出CO2,降低CO2的浓度,保持O2的浓度,使平衡正向移动,提高碳酸锰的转化率;故答案为:保持O2的浓度,降低CO2的浓度,使平衡正向移动,提高碳酸锰的转化率。
(3)①根据图中的信息得出常压下,要提高MnCO3的转化率,应选择的生产条件是湿空气中,350℃左右焙烧6![]() 8h;故答案为:湿空气中,350℃左右。
8h;故答案为:湿空气中,350℃左右。
②图3中,焙烧8h时,MnCO3的转化率:干空气<湿空气,原因是湿空气中会吸收部分的二氧化碳,降低二氧化碳的浓度,平衡有利于正向移动,增大碳酸锰的转化率,也可能湿空气有催化剂,提高反应速率;故答案为:干空气中没有催化剂,反应速率比湿空气中慢,8h时未达到平衡。

【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。
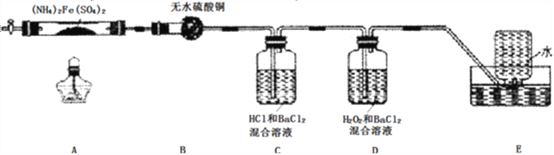
(1)B装置的作用是________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有______气体产生,写出D中发生反应的离子方程式____________________。若去掉C,是否能得出同样结论并解释其原因__________________________。
(3)A中固体分解后产生NH3,写出其两种用途________________________________________。
(4)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。请完成表内容。(试剂,仪器自选)
实验步骤 | 预期现象 | 结论 |
①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解; ②______________________________________________________ | 固体残留物仅为Fe2O3 |
(5) 用实验的方法验证C溶液含有NH4+___________________________________________。