��Ŀ����
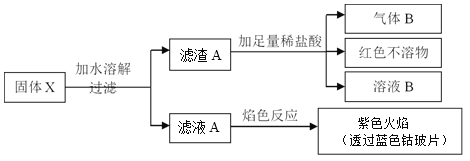
����Ŀ������ɫ����X�����ֳ�����Ԫ����ɣ�ʽ��Ϊ412����������ˮ�����ֽ⣬���±�ը��
��֪������B�ڱ�״���µ��ܶ�Ϊ1.25g.L-1���������ͨ��CuSO4��CuSO4�����Ϊ��ɫ��
��ش��������⣺
��1��д��A�ĵ���ʽ____________��
��2��д�����ɰ�ɫ����D�Ļ�ѧ����ʽ________________________��
��3������X����A���������C��Ũ��Һ��Ӧ���ɣ������ӷ���ʽΪ_________________
��4�������������C�ڼ�����������Fe2O3��Ӧ�����о���������в���+3�۵���Ԫ�أ������ʵ�鷽�������������п��ܵijɷ֣����û�ѧ������________________________
���𰸡�![]() SO2+I2+BaCl2+2H2O=BaSO4��+2HI+2HCl 3I2+5NH3��H2O=NI3��NH3+3NH4++3I-+5H2O ȡ���������������������������ͭ��Һ����ַ�Ӧ�����к�ɫ������֣�֤���������������õ���������ϡ���ᣬ�μ����軯����Һ�������ٵμ���ˮ������Һ�ʺ�ɫ����֤����������������
SO2+I2+BaCl2+2H2O=BaSO4��+2HI+2HCl 3I2+5NH3��H2O=NI3��NH3+3NH4++3I-+5H2O ȡ���������������������������ͭ��Һ����ַ�Ӧ�����к�ɫ������֣�֤���������������õ���������ϡ���ᣬ�μ����軯����Һ�������ٵμ���ˮ������Һ�ʺ�ɫ����֤����������������
��������
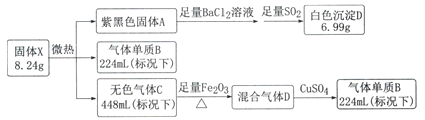
����B�ڱ�״���µ��ܶ�Ϊ1.25g.L-1������Ħ������Ϊ22.4L/mol��1.25 g.L-1=28 g/mol��Ϊ�������������ͨ��CuSO4��CuSO4�����Ϊ��ɫ��˵����������к���ˮ�����͵���������ǰ�����������仯��������ɫ����CΪ�������Ϻ�ɫ����AӦΪ�ⵥ�ʣ��������������Ȼ�����Ӧ�������ᱵ����������ɫ����6.99��Ϊ���ᱵ��������0.03mol��ͨ�����Ӽ���ⵥ�ʵ����ʵ���Ϊ0.03mol�����������ʵ���Ϊ0.01mol�����������ʵ���Ϊ0.02mol�������������ʵ�������Ϊ8.24�ˣ������ǹ���X������������X�Ļ�ѧʽΪNI3��NH3��
��1��AΪ�ⵥ�ʣ�����ʽΪ��![]() ��
��
��2���ⵥ�ʺͶ���������Ȼ�����ˮ��Ӧ�������ᱵ�����͵⻯������ᣬ����ʽΪ��SO2+I2+BaCl2+2H2O=BaSO4��+2HI+2HCl��
��3������X���ɵ���������就����Ũ��Һ��Ӧ���ɣ����ӷ���ʽΪ��3I2+5NH3��H2O=NI3��NH3+3NH4++3I-+5H2O ��
��4����������в���+3�۵���Ԫ�أ����Է�Ӧ����ܲ�����������������������������ͭ��Ӧ�û�����ɫ����ͭ�����Ƿ����������������ļ�����������������������軯���Ժ�ɫ�����ʽ��У���ʵ�����Ϊ��ȡ���������������������������ͭ��Һ����ַ�Ӧ�����к�ɫ������֣�֤���������������õ���������ϡ���ᣬ�μ����軯����Һ�������ٵμ���ˮ������Һ�ʺ�ɫ����֤����������������

 �����Ծ�ϵ�д�
�����Ծ�ϵ�д� �ο�����������100��ϵ�д�
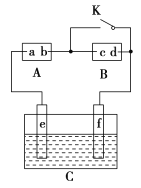
�ο�����������100��ϵ�д�����Ŀ��ɰ�����������г��� Karl Fischer���Dzⶨ������ˮ�������÷���������I2��SO2��Ӧ��������ˮ��Ϊԭ��(���������������ɷֲ��μӷ�Ӧ)���ݴ˻ش��������⣺
(1)д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ��_______________________��
����I����Ӧ��Ʒ�е�ˮ
��ͼ��ijͬѧ��ʵ����ģ��Karl Fischer����ʵ��װ��ͼ��

(2)װ�����ӵ�˳��Ϊa��____________(��ӿ���ĸ˳��)��M����������Ϊ________________������ʵ������е������ǣ�____________��
(3)��������Ϊ��������װ�ò����װ�������ԣ���װ��ҩƷ��____________________���۹رյ��ɼУ���Һ©���������ܷ�Ӧ�����رշ�Һ©������������ͨ��N2����ȡ��Dװ�ã�������
������м���ͨ��N2��Ŀ����________________________________
���� II���ⶨʣ��ĵ�
��Ӧ���Dװ�ü�������ˮ�����ˣ����ϴ�ӣ����ϲ�ϴ��Һ����Һ���������250.00mL��Һ��ȡ25.00mL��0.20mol��L-1 Na2S2O3��Һ�ζ�ʣ���I2���ʣ���֪��Ӧ���£�2S2O32��+I2=S4O62��+2I����
(4)Na2S2O3��ҺӦװ��_____________(������ʽ��������ʽ��)�ζ����У����������У��ϲ�ϴ��Һ����Һ��Ŀ����__________________________��
(5)�ζ�ʵ���ظ��Ĵεõ���������:
ʵ�� | �� | �� | �� | �� |
���ĵı�Һ�����/mL | 18.37 | 20.05 | 19.95 | 20.00 |
����ʵ�鿪ʼʱ����Dװ���м���10.00 g������Ʒ��10.16��I2(��֪I2����)������Ʒ������ˮ�ĺ���Ϊ_________%��
����Na2S2O3��Һ�Ѳ����������ʣ���ˮ�����ⶨ�����____________(����ƫ�������� ƫ��������������)��
����Ŀ������β��������̼����Ҫԭ��Ϊ2NO(g)��2CO(g)N2(g)��2CO2(g)����H��0����һ���¶��£�����̶�Ϊ2L���ܱ������У��ô�������ø÷�Ӧ�ڲ�ͬʱ���NO��COŨ�������ʾ��
ʱ��/s | c(NO)/(mol��L��1) | c(CO)/(mol��L��1) |
0 | 9.50��10��3 | 9.00��10��3 |
1 | 4.50��10��3 | 4.00��10��3 |
2 | 2.50��10��3 | 2.00��10��3 |
3 | 1.50��10��3 | 1.00��10��3 |
4 | 1.50��10��3 | 1.00��10��3 |
����˵����ȷ����
A.ǰ2 s�ڵ�ƽ����Ӧ����v(N2)��3.5��10��3mol��L��1��s��1
B.�����¶�ʱ���淴Ӧ������������Ӧ���ʼ�С
C.����������ѹǿ���ٷ����仯ʱ����Ӧ�ﵽƽ��״̬
D.�����������Ũ��c(NO)��c(CO)��c(N2)��c(CO2)��2��2��1��2ʱ����Ӧ�ﵽƽ��״̬