题目内容
【题目】有关实验现象叙述错误的是( )
A.硫蒸汽与H2混合生成H2S
B.NH3使含酚酞的水溶液变红,加热后又恢复到无色
C.NH4Cl固体受热会发生升华
D.浓硝酸久置后颜色会变黄
【答案】C
【解析】
A.硫蒸汽和H2反应会生成H2S,A正确;
B. NH3溶于水后,会和水生成一水合氨:![]() ,一水合氨会电离出氢氧根离子:
,一水合氨会电离出氢氧根离子:![]() ,溶液显碱性,能使酚酞变红,再加热,一水合氨分解,氨气逸出,恢复无色,B正确;
,溶液显碱性,能使酚酞变红,再加热,一水合氨分解,氨气逸出,恢复无色,B正确;
C. NH4Cl固体受热会分解成NH3和HCl,NH3和HCl在较冷的地方会再化合生成白烟,该过程是化学变化,不是升华(物理变化),C错误;
D. 浓硝酸久置后颜色会变黄:是因为硝酸见光发生了分解: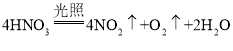 ,NO2留在了硝酸中显黄色,D正确;
,NO2留在了硝酸中显黄色,D正确;
答案选C。

【题目】硫代硫酸钠(Na2S2O3)俗称保险粉,可用作照相定影剂、纸浆漂白脱氯剂等。
实验室可通过反应2Na2S+Na2CO3+4SO2→3Na2S2O3+CO2制取Na2S2O3,装置如图所示。
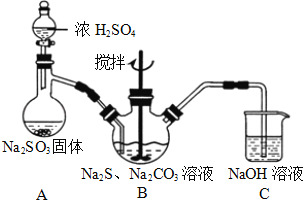
(1)装置B中搅拌器的作用是______;装置C中NaOH溶液的作用是_____。
(2)请对上述装置提出一条优化措施_______________________。
为测定所得保险粉样品中Na2S2O35H2O的质量分数,称取3.000g Na2S2O35H2O样品配成100mL溶液,用0.100mol/L标准碘溶液进行滴定,反应方程式为:2Na2S2O3+I2→2NaI+Na2S4O6
(3)滴定时用__________作指示剂,滴定时使用的主要玻璃仪器有________________。
(4)滴定时,若看到溶液局部变色就停止滴定,则样品中Na2S2O35H2O的质量分数测定值__________(填“偏高”、“偏低”或“不变”)。
(5)某学生小组测得实验数据如下:
实验次数 | 样品溶液体积(ml) | 滴定消耗0.100mol/L碘溶液体积(ml) |
1 | 20.00 | 9.80 |
2 | 20.00 | 10.70 |
3 | 20.00 | 9.90 |
该样品中Na2S2O35H2O的质量分数是_______。(精确到0.001)