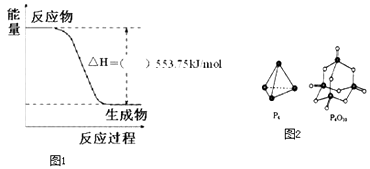
题目内容
【题目】已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是
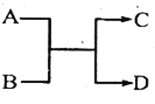
A. 若A为Fe,D为氢气,则B一定为酸
B. 若A、D为化合物,B为水,则C一定是气体单质
C. 若A、B、C、D均为化合物,该反应一定属于复分解反应
D. 若A、B、C、D均为10电子微粒(分子或离子),且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
【答案】D
【解析】试题分析:铁与水蒸气高温条件下能生成氢气,故A错误;若A、D为化合物,B为水,则C不一定是气体单质,如3NO2+H2O=2HNO3+NO,故B错误;若A、B、C、D均为化合物,该反应不一定属于复分解反应,如3NO2+H2O=2HNO3+NO,故C错误;C是可使湿润的红色石蕊试纸变蓝的气体,则C是氨气,若A、B、C、D均为10电子微粒,且生成氨气,该反应为:NH4++OH-=NH3+H2O,水在常温下呈液态,故D正确。

【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
A | B | C | D | |
强电解质 | Fe | CaCO3 | NaCl | HNO3 |
弱电解质 | CH3COOH | H3PO4 | NH3 | Fe(OH)3 |
非电解质 | 蔗糖 | 酒精 | BaSO4 | Al2O3 |
A. A B. B C. C D. D
【题目】利用如图装置制取ClO2 , 并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl. 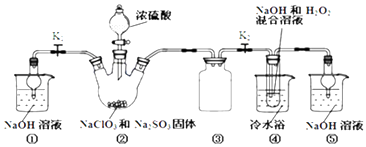
完成下列填空:
(1)装置②中产生ClO2的化学方程式为;装置④中发生反应的离子方程式为 .
(2)装置③的作用是;装置①和⑤在本实验中的作用 .
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是 .
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 molL﹣1Na2S2O3标准液滴定(I2+2S2O32﹣=2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 . 重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为 .
实验序号 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
(5)实验过程中若NaClO2变质可分解为NaClO3和NaCl.取等质量NaClO2 , 其中一份加热高于60℃使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”“不相同”或“无法判断”).
【题目】用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
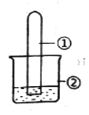
选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
A | NO2 | 蒸馏水 | 试管充满无色溶液 |
B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
C | NH3 | AlCl3溶液 | 产生白色沉淀 |
D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
A. A B. B C. C D. D