题目内容
17.下列表示对应化学反应的离子方程式正确的是( )| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO${\;}_{3}^{+}$+3H2O═3I2+6OH- | |
| B. | 向NH4HSO3溶液中加过量的NaOH溶液并加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| D. | Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O |
分析 A.酸性环境下不能生成氢氧根离子;
B.漏掉氢氧根离子与亚硫酸氢根离子的反应;
C.二者反应生成亚硫酸氢铵;
D.Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时,二者物质的量之比为1:1.
解答 解:A.用KIO3氧化酸性溶液中的KI,离子方程式:5I-+IO3-+6H+=3I2+3H2O,故A错误;
B.向NH4HSO3溶液中加过量的NaOH溶液并加热,离子方程式:HSO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+SO32-,故B错误;
C.将过量SO2通入冷氨水中,离子方程式:SO2+NH3•H2O═HSO3-+NH4+,故C正确;
D.Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时,离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应必须遵循客观事实,遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
11.下列叙述中,正确的是( )
| A. | 向待测溶液中加入AgNO3溶液出现白色沉淀,原溶液中一定含有Cl- | |
| B. | 用AgNO3溶液检验Cl-、Br-、I-时,必须用稀盐酸进行酸化 | |
| C. | 可以用新制的氨水和CCl4来鉴别Cl-、Br-、I- | |
| D. | 向某白色沉淀中加入稀硝酸,产生使澄清石灰水变浑浊的气体,则原白色沉淀一定为Ag2CO3 |
5.下表是元素周期表一部分,针对表中①~⑩种元素,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为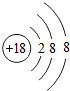 .
.
(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与④最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3 )⑨最高价氧化物的水化物电子式是 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.
(4)表中最高价氧化物的水化物中,酸性最强的是HClO4(填化学式)
(5)③元素与⑩元素两者核电荷数之差是26.
(6)在⑦与⑩的单质中,化学性质较活泼的物质名称是氯气,可用什么化学反应说明该事实(写出反应的离子方程式):Cl2+2Br-=2Cl-+Br2.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与④最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3 )⑨最高价氧化物的水化物电子式是
 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.(4)表中最高价氧化物的水化物中,酸性最强的是HClO4(填化学式)
(5)③元素与⑩元素两者核电荷数之差是26.
(6)在⑦与⑩的单质中,化学性质较活泼的物质名称是氯气,可用什么化学反应说明该事实(写出反应的离子方程式):Cl2+2Br-=2Cl-+Br2.
12.下列叙述中,指定粒子的数目约为6.02×1023的是( )
| A. | 标准状况下,22.4 L H2和CO混合气体中的原子数 | |
| B. | 1.6 gCH4中含有的电子数 | |
| C. | 24 g金属镁与足量的盐酸反应转移的电子数 | |
| D. | 1 mol•L-1的稀硫酸100 mL中含有H+的数目 |
2.在一密闭容器中,反应m A(g)+n B(g)?3C(g)达到平衡时,测得c(A)=0.5mol/L.在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.20mol/L.下列判断中正确的是( )
| A. | A的质量分数增大 | B. | 化学计量数:m+n>3 | ||
| C. | 平衡向右移动 | D. | 物质C的体积分数减小 |
9.化学知识在生产和生活中有着重要的应用.下列说法中,错误的是( )
| A. | 家中发生天然气泄漏,不能在室内用电话报警 | |
| B. | 明矾既可用于净水,又可杀菌消毒 | |
| C. | 双氧水可用于杀菌、消毒、漂白 | |
| D. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 |
6.用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 0.1 mol/L K2SO4 溶液中含有 K+为0.2 NA | |
| B. | 2.4g镁离子所含电子数目为NA | |
| C. | 足量铜与1L2mol•L-1稀硫酸反应可以生成H2分子总数为2NA | |
| D. | 标准状况下,44.8 L CCl4中含2NA个分子 |
7.下列实验操作或现象解释不正确的是( )
| A. | 进行焰色反应时,必须用稀硫酸洗涤并灼烧铂丝,然后再进行实验 | |
| B. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| C. | 读取滴定管内液体体积时,俯视读数导致读数偏小 | |
| D. | 利用一束强光照射明矾水溶液,产生光亮的“通路”,说明明矾一定发生了水解 |