题目内容
12.下列叙述中,指定粒子的数目约为6.02×1023的是( )| A. | 标准状况下,22.4 L H2和CO混合气体中的原子数 | |
| B. | 1.6 gCH4中含有的电子数 | |
| C. | 24 g金属镁与足量的盐酸反应转移的电子数 | |
| D. | 1 mol•L-1的稀硫酸100 mL中含有H+的数目 |
分析 A、标况下22.4L任何气体的物质的量为1mol,而氢气和CO均为双原子分子;
B、求出甲烷的物质的量,然后根据甲烷为10电子来分析;
C、求出镁的物质的量,然后根据反应后镁变为+2价来分析;
D、求出硫酸的物质的量,然后根据硫酸为二元强酸来分析.
解答 解:A、标况下22.4L任何气体的物质的量为1mol,而氢气和CO均为双原子分子,故1mol混合气体中含2mol原子即2NA个,故A错误;
B、1.6g甲烷的物质的量为0.1mol,而甲烷为10电子,故0.1mol甲烷中含NA个电子,故B正确;
C、24g镁的物质的量为1mol,而反应后镁变为+2价,故1mol镁转移2mol电子即2NA个,故C错误;
D、溶液中硫酸的物质的量n=CV=1mol/L×0.1L=0.1mol,而硫酸为二元强酸,故0.1mol硫酸中含0.2mol氢离子,即0.2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.固体碘化铵置于密闭容器中,加热至一定温度后恒温;容器中发生反应:
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g),
平衡时,测得总压为5.0kPa,其中H2的分压为0.5kPa,则下列说法中正确的是( )
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g),
平衡时,测得总压为5.0kPa,其中H2的分压为0.5kPa,则下列说法中正确的是( )
| A. | 固体碘化铵一定完全分解 | |
| B. | 若开始放入固体NH4I的量增大一倍,则平衡总压也会增大一倍 | |
| C. | 平衡时HI分解率为40% | |
| D. | 平衡时NH3的分压为2.5kPa |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO${\;}_{3}^{+}$+3H2O═3I2+6OH- | |
| B. | 向NH4HSO3溶液中加过量的NaOH溶液并加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| D. | Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O |
2.N2O俗称“笑气”,曾用作可吸入性麻醉剂.用以下反应可制取N2O:CO+NO2→CO2+N2O.下列说法正确的是( )
| A. | 反应中每生成1mol N2O,消耗1.5mol CO | |
| B. | B等物质的量的N2O和CO2含有相等的电子数 | |
| C. | N2O只具有氧化性,无还原性 | |
| D. | 反应中每生成1mol N2O,电子转移的物质的量为3mol |
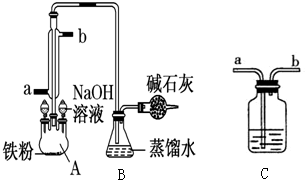 某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将两液体慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将两液体慢慢滴入反应器A(A下端活塞关闭)中.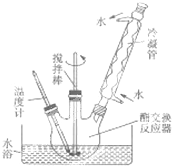 生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下:
生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下: 钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行防腐处理,可适当延长其使用寿命.
钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行防腐处理,可适当延长其使用寿命.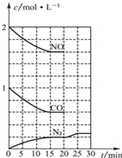 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.