题目内容
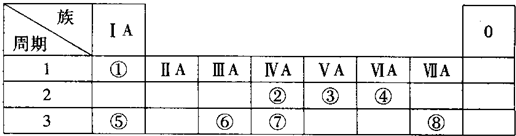
13.如图是元素周期表短周期的一部分,下列说法正确的是( )
| A. | 元素①于第二周期第IVA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 单质⑤遇足量元素①的氢化物有白烟 | D. | 元素的最高正化合价:③=⑤ |
分析 由元素在短周期中的位置,可知①为N、②为O、③为F、④为S、⑤为Cl.
A.N元素处于第二周期VA族;
B.非金属性越强,氢化物越稳定;
C.氯气与氨气反应可以生成氯化铵;
D.F元素没有最高正化合价.
解答 解:由元素在短周期中的位置,可知①为N、②为O、③为F、④为S、⑤为Cl.
A.N元素处于第二周期VA族,故A错误;
B.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,故气态氢化物的稳定性:④<②,故B错误;
C.氯气与氨气反应可以发生反应:3Cl2+8NH3=N2+6NH4Cl,有白烟产生,故C正确;
D.Cl元素最高正化合价为+7,而F元素没有最高正化合价,故D错误,
故选C.
点评 本题考查元素周期表与元素周期律应用,难度不大,需要学生熟练掌握周期表的结构,注意掌握周期表中一些特殊性.

练习册系列答案
相关题目
3.实验室有一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2SO”字样.已知固体M只可能是Na2SO3或Na2SO4.若取少量固体M配成溶液,下列试剂不能用于鉴定M的是( )
| A. | Ba(OH)2 | B. | 稀盐酸 | C. | 稀硫酸 | D. | 浓硝酸 |
1. 25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )
25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )
 25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )
25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )| A. | pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等 | |
| B. | 在①点时pH=6,溶液中:c(F-)-c(Na+)=9.9×10-7mol/L | |
| C. | 在②点时,溶液中:c(F-)<c(Na+) | |
| D. | 在③点时V=20mL,溶液中:c(F-)<c(Na+)=0.1mol/L |
8.下列化学方程式或离子方程式正确的是( )
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O | |
| B. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
2.常温下用0.1000mol/L盐酸滴定20.00mL0.1000mol/LNH3•H2O溶液,滴定曲线如图所示,下列说法正确的是( )
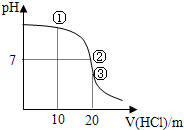

| A. | ①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)=c(Cl-)=c(OH-)=c(H)+ | |
| C. | ③溶液:含有的微粒数为5种 | |
| D. | 滴定过程中可能出现:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
3.对于常温下浓度为O.Olmol/L的醋酸溶液,以下说法正确的是( )
| A. | 由水电离出来的c(H+ )=l.0xl0-12 mol/L | |
| B. | c (CH3COOH)>c (H+ )>c (CH3COO- )>c (OH-) | |
| C. | 与同浓度的盐酸分别加水稀释10倍:pH (醋酸)<pH (盐酸) | |
| D. | 与等体积的氢氧化钠溶液反应:c (CH3COOH)+c (CH3COO- )=0.01mol/L. |