题目内容
3.实验室有一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2SO”字样.已知固体M只可能是Na2SO3或Na2SO4.若取少量固体M配成溶液,下列试剂不能用于鉴定M的是( )| A. | Ba(OH)2 | B. | 稀盐酸 | C. | 稀硫酸 | D. | 浓硝酸 |
分析 A.亚硫酸钠和氢氧化钡反应生成白色亚硫酸钡沉淀,硫酸钠和氢氧化钡反应生成白色硫酸钡沉淀;
B.亚硫酸钠和盐酸反应生成刺激性的二氧化硫,而硫酸钠和盐酸不反应;
C.亚硫酸钠和稀硫酸反应生成刺激性的二氧化硫,而硫酸钠和稀硫酸不反应;
D.亚硫酸钠和浓硝酸反应生成红棕色二氧化氮气体,而硫酸钠和浓硝酸不反应.
解答 解:A.亚硫酸钠、硫酸钠分别和氢氧化钡溶液反应均生成白色沉淀,现象相同,不能鉴别,故A错误;
B.亚硫酸钠和盐酸反应Na2SO3+2HCl═2NaCl+H2O+SO2↑,而硫酸钠不能和盐酸反应,能用于鉴定M,故B正确;
C.亚硫酸钠和稀硫酸反应:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,而硫酸钠不能和稀硫酸反应,能用于鉴定M,故C正确;
D.稀硝酸具有强氧化性,能将亚硫酸根离子氧化成硫酸根离子,自身被还原成红棕色二氧化氮气体,而硫酸钠和浓硝酸不反应,能用于鉴定M,故D正确;
故选A.
点评 本题考查离子的检验,把握物质发生的化学反应及现象为解答的关键,注意常见离子的特征反应、注意干扰离子的分析判断,题目难度中等.

练习册系列答案
相关题目
13.如图是元素周期表短周期的一部分,下列说法正确的是( )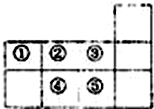

| A. | 元素①于第二周期第IVA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 单质⑤遇足量元素①的氢化物有白烟 | D. | 元素的最高正化合价:③=⑤ |
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.
 ,C
,C ,D
,D .
.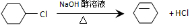 ;
; ;
; .
. C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).
C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).

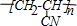 ,反应所属类型分别为加成反应、加聚反应.
,反应所属类型分别为加成反应、加聚反应.