题目内容
1.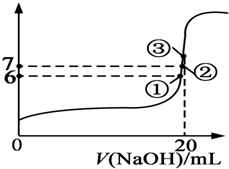 25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )
25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )| A. | pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等 | |
| B. | 在①点时pH=6,溶液中:c(F-)-c(Na+)=9.9×10-7mol/L | |
| C. | 在②点时,溶液中:c(F-)<c(Na+) | |
| D. | 在③点时V=20mL,溶液中:c(F-)<c(Na+)=0.1mol/L |
分析 A.酸或碱抑制了水电离,含有弱根离子的盐促进水电离;
B.在①点时pH=6,溶液显示酸性,根据电荷守恒分析;
C.在②点时,溶液为中性,根据电荷守恒分析离子浓度大小;
D.等物质的量的氢氟酸和氢氧化钠恰好反应生成氟化钠,溶液呈碱性,根据电荷守恒判断,注意等体积混合时,不水解离子浓度变为原来的一半.
解答 解:A.氢氟酸抑制水电离,氟化钠促进水电离,所以pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的不相等,故A错误;
B.①点时pH=6,溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),所以c(F-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,故B正确;
C.②点时,溶液呈中性,c(OH-)=c(H+),溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),所以c(F-)=c(Na+),故C错误;
D.③点时V=20mL,此时溶液中溶质在氟化钠,溶液呈碱性,根据电荷守恒知c(F-)<c(Na+),但等体积混合时不水解的离子浓度变为原来的一半,所以c(F-)<c(Na+)=0.05mol/L,故D错误;
故选B.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答原理,注意掌握溶液酸碱混合的定性判断及溶液pH的计算方法.

练习册系列答案
相关题目
9. 常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
 常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | 在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | K点对应的溶液中,有c( MOH)+c( M+)=0.02 mol.L-1 |
16.已知充分燃烧amol乙炔气体时生成1mol CO2气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2b kJ/mol | |
| B. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4b kJ/mol | |
| C. | C2H2(g)+O2(g)═2CO2(g)+H2O(l)△H=+2b kJ/mol | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-$\frac{b}{a}$kJ/mol |
6.下列说法正确的是( )
| A. | 可以用澄清石灰水鉴别SO2和CO2 | |
| B. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| C. | SO2能使溴水、酸性KMnO4溶液褪色 | |
| D. | 少量SO2通过浓的氯化钙溶液能生成白色沉淀 |
13.如图是元素周期表短周期的一部分,下列说法正确的是( )

| A. | 元素①于第二周期第IVA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 单质⑤遇足量元素①的氢化物有白烟 | D. | 元素的最高正化合价:③=⑤ |
10.对乙烯基苯甲酸在医药中间体合成中有着广泛的用途,可用化合物M反应合成.下列关于化合物M和对乙烯基苯甲酸的说法正确的是( )


| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸即属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和聚合反应 |
11.X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如表所示.Z元素原子最外层电子数是内层电子总数的$\frac{1}{5}$.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为X<Y<Z<W | |
| B. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物更加稳定 |

 ,C
,C ,D
,D .
. ;
; ;
; .
.