题目内容
2.常温下用0.1000mol/L盐酸滴定20.00mL0.1000mol/LNH3•H2O溶液,滴定曲线如图所示,下列说法正确的是( )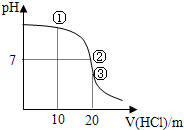
| A. | ①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)=c(Cl-)=c(OH-)=c(H)+ | |
| C. | ③溶液:含有的微粒数为5种 | |
| D. | 滴定过程中可能出现:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
分析 A、用10mL0.1000mol/L盐酸和20.00mL0.1000mol/LNH3•H2O溶液反应,得到的是氯化铵和氨水的混合物;
B、②溶液显示中性,根据溶液中的电荷守恒来计算回答;
C、20mL0.1000mol/L盐酸和20.00mL0.1000mol/LNH3•H2O溶液反应,得到的是氯化铵溶液;
D、滴定过程中可能出现盐酸相对于氨水过量、不足、恰好反应等情况,据此回答判断.
解答 解:A、用10mL0.1000mol/L盐酸和20.00mL0.1000mol/LNH3•H2O溶液反应,得到的是氯化铵和氨水的混合物,溶液显示碱性,c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A错误;
B、②溶液显示中性,根据溶液中的电荷守恒,得到:c(NH4+)=c(Cl-)>c(OH-)=c(H)+,故B错误;
C、③是20mL0.1000mol/L盐酸和20.00mL0.1000mol/LNH3•H2O溶液反应,得到的是氯化铵溶液,含有的微粒数为4种:铵根离子、氯离子、氢离子、氢氧根离子,故C错误;
D、滴定过程中可能出现盐酸相对于氨水过量、不足、恰好反应等情况,存在c(NH4+)>c(OH-)>c(Cl-)>c(H+),可以是剩余大量的氨水以及生成少量的氯化铵时的情况,故D正确.
故选D.
点评 本题考查学生酸碱之间的反应情况以及溶液中离子浓度的大小关系比较知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
13.如图是元素周期表短周期的一部分,下列说法正确的是( )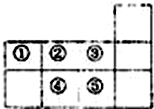

| A. | 元素①于第二周期第IVA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 单质⑤遇足量元素①的氢化物有白烟 | D. | 元素的最高正化合价:③=⑤ |
10.对乙烯基苯甲酸在医药中间体合成中有着广泛的用途,可用化合物M反应合成.下列关于化合物M和对乙烯基苯甲酸的说法正确的是( )
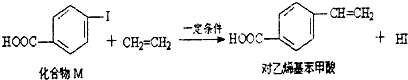

| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸即属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和聚合反应 |
17. 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可能循环的 | |
| B. | 燃料电池系统产生的能量实际上来自于水 | |
| C. | 水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ | |
| D. | 燃料电池放电时的正极反应:O2+4e-+2H2O=4OH - |
11.X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如表所示.Z元素原子最外层电子数是内层电子总数的$\frac{1}{5}$.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为X<Y<Z<W | |
| B. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物更加稳定 |
 .
. .
.