题目内容
5.(1)将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈酸性(填“酸”、“中”或“碱”),溶液中c(NH4+)<c(Cl-)(“>”“=”“<”).(2)pH=3盐酸和pH=11氨水等体积混合后溶液呈碱性(填“酸”、“中”或“碱”),溶液中c(NH4+)>c(Cl-)(“>”“=”“<”).
(3)写出NaHCO3水溶液呈碱性的水解离子方程式HCO3-+H2O?H2CO3+OH-;
(4)含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S)?Ag+ (aq)+Cl-(aq)
在25℃时,氯化银的Ksp=1.8×10-10mol2•L-2.现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.1mol•L-1氯化镁溶液中;③100mL 0.1mol•L-1氯化铝溶液中;④100mL 0.1mol•L-1盐酸溶液中.充分搅拌后,相同温度下银离子浓度由大到小的顺序是①④②③(填写序号).
分析 (1)二者反应后恰好生成氯化铵,根据盐的水解判断溶液酸碱性;根据铵根离子部分水解判断c(NH4+)与c(Cl-)的大小关系;
(2)氨水为弱碱,溶液中部分电离,二者等体积混合后氨水过量,溶液显示碱性;根据电荷守恒判断溶液中c(NH4+)与c(Cl-)的大小;
(3)NaHCO3水溶液呈碱性,是弱离子碳酸氢根离子结合水中的氢离子,水解离子方程式为:HCO3-+H2O?H2CO3+OH-;
(4)氯化银饱和溶液中存在沉淀溶解平衡,依据溶度积计算.
解答 解:(1)将等体积等物质的量浓度的盐酸和氨水混合后,反应前后生成氯化铵,溶液中铵根离子部分水解,溶液显示酸性;由于铵根离子部分水解,所以溶液中c(NH4+)<c(Cl-),
故答案为:酸;<;
(2)将pH=3的盐酸和pH=11的氨水等体积混合,氨水部分电离,混合后氨水过量,溶液显示碱性,则c(H+)<c(OH-);根据电荷守恒可知:c(NH4+)+c(H+)=c(OH-)+c(Cl-),所以溶液中c(NH4+)>c(Cl-),
故答案为:碱;>;
(3)NaHCO3水溶液呈碱性,是弱离子碳酸氢根离子结合水中的氢离子,水解离子方程式为:HCO3-+H2O?H2CO3+OH-,故答案为:HCO3-+H2O?H2CO3+OH-;
(4)Ksp=1.8×10-10mol2•L-2=C(Ag+)•C(Cl-),通过计算分别得到:①100mL蒸馏水中含银离子浓度和氯离子浓度相同;②100mL 0.1mol•L-1氯化镁溶液中氯离子浓度为0.2mol/L,Ag+浓度为9×10-10mol/L;③100mL 0.1mol•L-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;④100mL 0.1mol•L-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L,综上所述大小顺序为①④②③,故答案为:①④②③.
点评 本题考查了盐溶液酸碱性的判断、溶液中离子浓度的关系等知识点,题目难度较大,根据温度、电解质溶液对难溶物性质的影响和电荷守恒、物料守恒来分析解答即可.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2b kJ/mol | |
| B. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4b kJ/mol | |
| C. | C2H2(g)+O2(g)═2CO2(g)+H2O(l)△H=+2b kJ/mol | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-$\frac{b}{a}$kJ/mol |
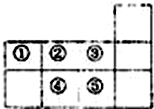
| A. | 元素①于第二周期第IVA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 单质⑤遇足量元素①的氢化物有白烟 | D. | 元素的最高正化合价:③=⑤ |
| A. | 9 | B. | 16 | C. | 20 | D. | 25 |
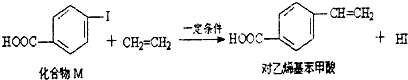
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸即属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和聚合反应 |
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可能循环的 | |
| B. | 燃料电池系统产生的能量实际上来自于水 | |
| C. | 水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ | |
| D. | 燃料电池放电时的正极反应:O2+4e-+2H2O=4OH - |
 C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).
C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).

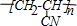 ,反应所属类型分别为加成反应、加聚反应.
,反应所属类型分别为加成反应、加聚反应.