题目内容
18.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题.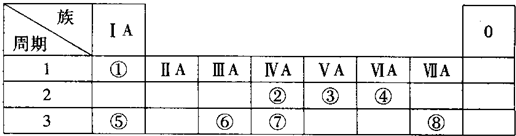
a.④、⑤、⑥的原子半径由大到小的顺序是Na>Al>O.
b.②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
C.③、④、⑥元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.用化学式表示下列4种微粒
AH2O、BNH3、CNH4+、DOH-并写出A、B、E三种微粒反应的离子方程式Al3++3NH3+3H2O=Al(OH)3↓+3NH4+.
d.②和浓硫酸反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
a.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
b.同周期自左而右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强;
c.N、O、Al元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D,则A为H2O、B为NH3、C为NH4+、D为OH-;A、B、E三种微粒反应后可得C和一种白色沉淀,则E为Al3+;
d.碳与浓硫酸在加热条件下生成二氧化碳、二氧化硫与水.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl.
a.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
b.同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
c.N、O、Al元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D,则A为H2O、B为NH3、C为NH4+、D为OH-;A、B、E三种微粒反应后可得C和一种白色沉淀,则E为Al3+,A、B、E三种微粒反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
故答案为:H2O; NH3;NH4+;OH-;Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;
d.碳与浓硫酸在加热条件下生成二氧化碳、二氧化硫与水,反应方程式为:C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
点评 本题考查元素周期表与元素周期律综合应用,需要学生熟练掌握元素周期表的结构,有利于基础知识的巩固.

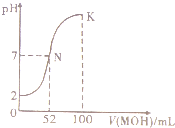 常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | 在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | K点对应的溶液中,有c( MOH)+c( M+)=0.02 mol.L-1 |
| A. | 可以用澄清石灰水鉴别SO2和CO2 | |
| B. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| C. | SO2能使溴水、酸性KMnO4溶液褪色 | |
| D. | 少量SO2通过浓的氯化钙溶液能生成白色沉淀 |
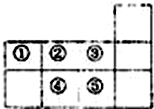
| A. | 元素①于第二周期第IVA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 单质⑤遇足量元素①的氢化物有白烟 | D. | 元素的最高正化合价:③=⑤ |
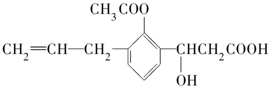 某有机化合物的结构简式如下:此有机化合物属于( )
某有机化合物的结构简式如下:此有机化合物属于( )①烯烃 ②多官能团有机化合物
③芳香烃 ④烃的衍生物.
| A. | ①②③④ | B. | ②④ | C. | ②③ | D. | ①③ |
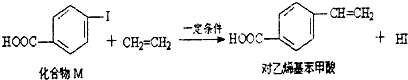
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸即属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和聚合反应 |
 .
. .
.