题目内容
3.对于常温下浓度为O.Olmol/L的醋酸溶液,以下说法正确的是( )| A. | 由水电离出来的c(H+ )=l.0xl0-12 mol/L | |
| B. | c (CH3COOH)>c (H+ )>c (CH3COO- )>c (OH-) | |
| C. | 与同浓度的盐酸分别加水稀释10倍:pH (醋酸)<pH (盐酸) | |
| D. | 与等体积的氢氧化钠溶液反应:c (CH3COOH)+c (CH3COO- )=0.01mol/L. |
分析 A.醋酸为弱电解质,不能完全电离;
B.醋酸部分电离,且溶液中存在水的电离;
C.盐酸完全电离,稀释等体积时,盐酸溶液中氢离子浓度较大;
D.与等浓度等体积NaOH溶液反应,体积增大一倍,浓度减半.
解答 解:A.醋酸为弱电解质,不能完全电离,则0.01mo1/L的醋酸溶液中,由水电离出来的c(H+)>1.0×10-12mo1/L,故A错误;
B.醋酸部分电离,且电离程度较小,则c(CH3COOH)>c(H+),因溶液中存在水的电离,则c(H+)>c(CH3COO-)>c(OH-),故B正确;
C.盐酸完全电离,稀释等体积时,盐酸溶液中氢离子浓度较大,pH(醋酸)>pH(盐酸),故C错误;
D.与等浓度等体积NaOH溶液反应,体积增大一倍,浓度减半,应为c(CH3COOH)+c(CH3COO-)=0.05mo1/L,况且本题没有告诉浓度关系,故D错误.
故选B.
点评 本题考查了弱电解质的电离平衡,溶液pH计算,溶液中离子浓度大小比较,关键是理解电离平衡微弱,影响电离平衡的因素应用.

练习册系列答案
相关题目
13.如图是元素周期表短周期的一部分,下列说法正确的是( )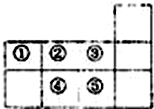

| A. | 元素①于第二周期第IVA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 单质⑤遇足量元素①的氢化物有白烟 | D. | 元素的最高正化合价:③=⑤ |
11.X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如表所示.Z元素原子最外层电子数是内层电子总数的$\frac{1}{5}$.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为X<Y<Z<W | |
| B. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物更加稳定 |
18.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| B. | 标准状态下,33.6 L氟化氢中含有1.5 NA个氟化氢分子 | |
| C. | 0.1 mol/L的 Al2(SO4)3溶液中,Al3+的数目小于0.2 NA | |
| D. | 1 mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
17.某溶液中含有大量的Cl-、CO32-、OH-,如果只取一次该溶液分别将三种离子检验出来,下列添加试剂的顺序正确的是( )
| A. | 先加Mg(NO3)2,再加Ca(NO3)2,最后加AgNO3 | |
| B. | 先加Ca(NO3)2,再加AgNO3,最后加Mg(NO3)2 | |
| C. | 先加AgNO3,再加Ca(NO3)2,最后加Mg(NO3)2 | |
| D. | 先加Ca(NO3)2,再加Mg(NO3)2,最后加AgNO3 |