题目内容
20.下列叙述中正确的是( )| A. | 科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2═HCOONa+H2O.储氢、释氢过程均无能量变化 | |
| B. | 2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的热效应相同 | |
| C. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 | |
| D. | 过程N2(g)-→2N(g)放出能量 |
分析 A.储氢释氢是化学变化,化学变化中一定伴随能量变化;
B.反应热与热化学方程式的系数成正比;
C.利用太阳能和催化剂分解水没有污染;
D.断键需吸收热量.
解答 解:A.储氢释氢NaHCO3+H2═HCOONa+H2O,储氢、释氢过程都是化学变化,化学变化中一定伴随能量变化,故A错误;
B.NaHCO3晶体是离子晶体,由NaB.反应热与热化学方程式的系数成正比,所以4SO2(g)+2O2(g)═4SO3(g)的热效应是2SO2(g)+O2(g)═2SO3(g)2倍,故B错误;
C.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能,不消耗能源,也不产生污染,是一种绿色化学方法,故C正确;
D.断键需吸收热量,所以过程N2(g)-→2N(g)吸收热量,故D错误;
故选C.
点评 本题考查较为综合,涉及太阳能、储氢过程中的能量变化、化学键的断裂等知识,题目难度不大,注意对相关知识的积累,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
10.两种物质以任意质量比混合,如混合物的质量一定,充分燃烧时产生的二氧化碳的量是定值,则混合物的组成可能是( )
| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |
11.下列过程属于固氮的是( )
| A. | 分离液态空气制氮气 | B. | 闪电时氮气转化为一氧化氮 | ||
| C. | 氨气和硫酸反应制化肥 | D. | 氨气催化氧化制硝酸 |
8.NH3分子的空间构型是三角锥形,而不是正三角形的平面结构,其充分的理由是( )
| A. | NH3分子是非极性分子 | |
| B. | 分子内3个N-H键的键长相等,键角相等 | |
| C. | NH3分子内3个N-H键的键长相等,3个键角都等于107°18′ | |
| D. | NH3分子内3个N-H键的键长相等,3个键角都等于120° |
15.某元素的最高价氧化物的分子式RO2,其中含R27.27%.对此元素的叙述不正确的是( )
| A. | 该元素为碳 | B. | 该元素的气态氢化物含H 25% | ||
| C. | RO2为极性分子 | D. | RO2与水反应能生成酸 |
12.己烯雌酚是一种激素类药物,结构如下:
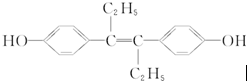
,下列有关叙述中不正确的是( )

,下列有关叙述中不正确的是( )
| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3溶液发生反应 | |
| C. | 该有机物分子中一定有14个碳原子共平面 | |
| D. | 1 mol该有机物可与5 mol Br2发生反应 |
9.非金属元素R其质量数为127,又知R离子含有74个中子,54个电子,则该元素最高化合价组成的化合物是( )
| A. | R(OH)3 | B. | R2O7 | C. | HRO3 | D. | H2R |
10. 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
| A. | 前5min反应的平均速率v(N2O4)=0.36mol•(L•min)-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 反应①、②均为吸热反应 | |
| D. | 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
