题目内容
15.某元素的最高价氧化物的分子式RO2,其中含R27.27%.对此元素的叙述不正确的是( )| A. | 该元素为碳 | B. | 该元素的气态氢化物含H 25% | ||
| C. | RO2为极性分子 | D. | RO2与水反应能生成酸 |
分析 A.某元素的最高价氧化物的分子式RO2,含R 27.27%,设其相对原子质量为x,则$\frac{x}{16×2+x}$=27.27%,解得x=12,则该元素是C元素;
B.其氢化物为CH4,结合化学式计算H元素质量分数;
C.CO2分子为直线型结构,分子中正负电荷重心重合;
D.二氧化碳和水反应生成碳酸.
解答 解:A.某元素的最高价氧化物的分子式RO2,含R 27.27%,设其相对原子质量为x,则$\frac{x}{16×2+x}$=27.27%,解得x=12,则该元素是C元素,故A正确;
B.其氢化物为CH4,H元素质量分数=$\frac{4}{12×4}$=25%,故B正确;
C.CO2分子为直线型结构,分子中正负电荷重心重合,属于非极性分子,故C错误;
D.二氧化碳和水发生反应为CO2+H2O=H2CO3,生成碳酸,故D正确;
故选C.
点评 本题考查原子结构和性质的关系,关键是根据质量分数确定该元素,再结合物质结构、性质解答,难度不大.

练习册系列答案
相关题目
10.下列指定粒子的个数比不为2:1的是( )
| A. | Be2+中的质子数和电子数比 | |
| B. | ${\;}_{1}^{3}$H原子中的中子数和电子数 | |
| C. | Na2CO3晶体中阳离子和阴离子个数比 | |
| D. | BaO2(过氧化钡)固体中阴离子和阳离子个数比 |
20.下列叙述中正确的是( )
| A. | 科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2═HCOONa+H2O.储氢、释氢过程均无能量变化 | |
| B. | 2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的热效应相同 | |
| C. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 | |
| D. | 过程N2(g)-→2N(g)放出能量 |
7.下列实验能获得成功的是( )
| A. | 苯和浓溴水用Fe作为催化剂制溴苯 | |
| B. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入AgNO3溶液检验Cl- | |
| C. | CH4与Cl2在光照条件下得到纯净的CH3Cl | |
| D. | 乙烯通入溶有Br2的CCl4溶液可得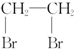 |
