题目内容
10.两种物质以任意质量比混合,如混合物的质量一定,充分燃烧时产生的二氧化碳的量是定值,则混合物的组成可能是( )| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |
分析 两种物质以任意质量比混合,如混合物的质量一定,充分燃烧时产生的二氧化碳的量是定值,根据碳元素守恒,则混合物各组分中碳元素质量分数相等.
解答 解:两种物质以任意质量比混合,如混合物的质量一定,充分燃烧时产生的二氧化碳的量是定值,根据碳元素守恒,则混合物各组分中碳元素质量分数相等,
A.乙醇为C2H6O,与C3H9O1.5中碳元素质量分数相等,而丙醇为C3H8O,乙醇与丙醇中碳元素质量分数不相等,故A错误;
B.乙醇为C2H6O,乙二醇为C2H6O2,二者碳元素质量分数不相等,故B错误;
C.1-丙醇、2-丙醇分子式均为C3H8O,二者碳元素质量分数相等,故C正确;
D.乙烯、乙烷的最简式不同,二者碳元素质量分数不相等,故D错误,
故选C.
点评 本题考查混合物计算,注意利用碳元素守恒判断混合物各组分中碳元素质量分数相等,侧重考查学生分析计算能力,难度中等.

练习册系列答案
相关题目
15.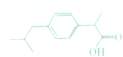 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
 布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )
布洛芬属于丁苯丙酸的一种,是世界卫生组织推荐的儿童抗炎退烧药,其结构如图所示,下列说法不正确的是( )| A. | 布洛芬的分子式为C12H18O3 | |
| B. | 布洛芬与苯甲酸(C6H5COOH)互为同系物 | |
| C. | 布洛芬能发生加成、取代等反应 | |
| D. | 丁苯丙酸共有12种可能的结构 |
15.核电荷数为1~18的元素中,下列叙述正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素一定是金属元素 | |
| D. | 核电荷数为17的元素的原子的质量数一定是35 |
2.如表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: .
.
(3)最高价氧化是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程: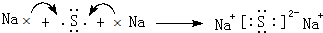 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)表示①与⑦的化合物的电子式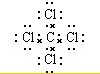 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)最高价氧化是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
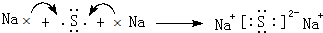 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)表示①与⑦的化合物的电子式
 .
.
19.已知如表数据:
某学生做乙酸乙酯的制备实验
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是漏加浓硫酸.
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是乙醇的沸点低,易挥发而损耗.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338 | 1.84 |
(1)写出该反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是漏加浓硫酸.
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是乙醇的沸点低,易挥发而损耗.
20.下列叙述中正确的是( )
| A. | 科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2═HCOONa+H2O.储氢、释氢过程均无能量变化 | |
| B. | 2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的热效应相同 | |
| C. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 | |
| D. | 过程N2(g)-→2N(g)放出能量 |