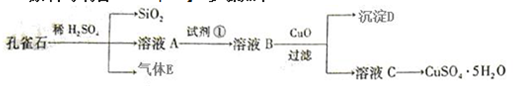
题目内容
16.下列描述中正确的是( )①CS2为V形的极性分子
②ClO3-的空间构型为平面三角形
③SF6中有6对完全相同的成键电子对
④SiF4和SO32-的中心原子均为sp3杂化.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
分析 ①CS2与CO2分子构型相同,根据二氧化碳的分子结构分析;
②先求出中心原子的价层电子对数,再判断分子构型;
③SF6中S-F含有一个成键电子对;
④先求出中心原子的价层电子对数,再判断杂化类型.
解答 解:①CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,故错误;
②ClO3-中Cl的价层电子对数=3+$\frac{1}{2}$(7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故错误;
③SF6中S-F含有一个成键电子对,所以SF6中含有6个S-F键,则分子中有6对完全相同的成键电子对,故正确;
④SiF4中Si的价层电子对数=4+$\frac{1}{2}$(4-1×4)=4,SO32-中S的价层电子对数=3+$\frac{1}{2}$(6+2-2×3)=4,所以中心原子均为sp3杂化,故正确.
故选C.
点评 本题考查分子的构型、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,知道孤电子对个数的计算方法,为易错点.

练习册系列答案
相关题目
7.已知氯元素某种原子的质量是a g,12C原子的质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 由题中信息可知 NA的值为$\frac{12}{b}$ | |
| B. | Wg该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol | |
| C. | W g该原子中含有的电子数为$\frac{17W}{a{N}_{A}}$ | |
| D. | 该原子的摩尔质量是aNAg/mol |
5.有可逆反应aA(g)+bB(g)?cC(g)+dD(g)△H,试根据图示下列判断错误的是( )
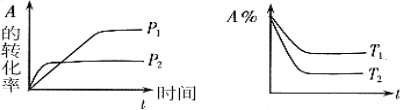
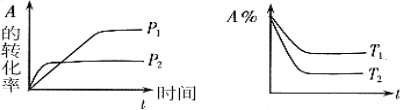
| A. | 压强P1<P2 | B. | a+b<c+d | C. | T1<T2 | D. | △H<0 |
6.某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等. 水垢会形成安全隐患,需及时清洗除去.清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉.
(1)用NaOH溶解二氧化硅的化学方程式是SiO2+2NaOH═Na2SiO3+H2O.
(2)已知:20℃时溶解度/g
则步骤Ⅰ中加入Na2CO3可除去水垢中的CaSO4.
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有CaCO3、Mg(OH)2、SiO2.
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因2Fe3++Fe═3Fe2+.
(4)步骤Ⅲ中,加入Na2SO3的目的是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉.(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
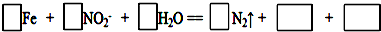
②如果有16.8g铁被钝化,则转移的电子数为4.82×1023(保留三位有效数字).
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉.
(1)用NaOH溶解二氧化硅的化学方程式是SiO2+2NaOH═Na2SiO3+H2O.
(2)已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有CaCO3、Mg(OH)2、SiO2.
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因2Fe3++Fe═3Fe2+.
(4)步骤Ⅲ中,加入Na2SO3的目的是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉.(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
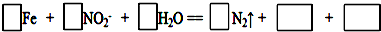
②如果有16.8g铁被钝化,则转移的电子数为4.82×1023(保留三位有效数字).
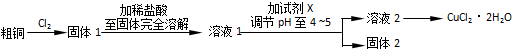
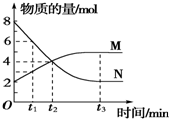 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题:
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题: