��Ŀ����
11��������Ԫ��A��B��C��D�У�0.5molAԪ�ص����ӵõ�6.02��1023�����Ӻ�ԭΪ����ԭ�ӣ�0.4gA��������ǡ����100mL 0.2mol/L ��������ȫ��Ӧ��AԪ��ԭ�Ӻ�������������������ȣ�BԪ��ԭ�Ӻ����������AԪ��ԭ�Ӻ����������1��C-���Ӻ�����Ӳ�����AԪ�ص����Ӻ�����Ӳ�����1��DԪ��ԭ�������������Ǵ�����2��������д���пո���1��A��B��C��D����Ԫ�صķ���AMg��BAl��CCl��DC��
��2��ͨ��״���£�A��B��C��D���ֵ��������ڽ����������þ��������д�������ƣ���ͬ��������ԭ�Ӿ�����ǽ��ʯ��
��3��C��D��Ԫ����ɵ����ʣ������ں��м��Լ�������ԡ��Ǽ��ԡ�����ͬ���������Ϊ�Ǽ��Է��ӣ�
��4��A��B��C����Ԫ�ص����Ӱ뾶�ɴ�С��˳��Ϊ��Cl-��Mg2+��Al3+�������ӷ��ű�ʾ����
���� ������Ԫ��A��B��C��D�У�0.5mol AԪ�ص����ӵõ�6.02��1023�����ӱ���ԭΪ����ԭ�ӣ���A����Ϊ��������λ����ɵ������ӣ�0.4g A��������ǡ����100ml 0.2mol/L��������ȫ��Ӧ����AO+2HCl�TACl2+H2O��M��AO��=$\frac{0.4g}{0.01mol}$=40g/mol������A��Ħ������Ϊ40g/mol-16g/mol=24g/mol����Aԭ�Ӻ���������Ŀ��������Ŀ��ȣ���������Ϊ12����AΪMgԪ�أ�BԪ��ԭ�Ӻ����������AԪ��ԭ�Ӻ����������1����BΪAl��C-���Ӻ�����Ӳ�����AԪ�ص����Ӻ�����Ӳ�����1����CΪCl��DԪ��ԭ�������������Ǵ�����2����ԭ��ֻ����2�����Ӳ㣬����������Ϊ4����DΪCԪ�أ��ݴ˽��
��� �⣺������Ԫ��A��B��C��D�У�0.5mol AԪ�ص����ӵõ�6.02��1023�����ӱ���ԭΪ����ԭ�ӣ���A����Ϊ��������λ����ɵ������ӣ�0.4g A��������ǡ����100ml 0.2mol/L��������ȫ��Ӧ����AO+2HCl�TACl2+H2O��M��AO��=$\frac{0.4g}{0.01mol}$=40g/mol������A��Ħ������Ϊ40g/mol-16g/mol=24g/mol����Aԭ�Ӻ���������Ŀ��������Ŀ��ȣ���������Ϊ12����AΪMgԪ�أ�BԪ��ԭ�Ӻ����������AԪ��ԭ�Ӻ����������1����BΪAl��C-���Ӻ�����Ӳ�����AԪ�ص����Ӻ�����Ӳ�����1����CΪCl��DԪ��ԭ�������������Ǵ�����2����ԭ��ֻ����2�����Ӳ㣬����������Ϊ4����DΪCԪ�أ�
��1��������������֪��AΪMg��BΪAl��CΪCl��DΪCԪ�أ��ʴ�Ϊ��Mg��Al��Cl��C��
��2��ͨ��״���£�A��B��C��D���ֵ��������ڽ����������þ����������ԭ�Ӿ�����ǽ��ʯ���ʴ�Ϊ��þ���������ʯ��
��3��C��D��Ԫ����ɵ�����ΪCCl4�������ں��м��Լ���Ϊ�������幹�ͣ������Ϊ�Ǽ��Է��ӣ��ʴ�Ϊ�����ԣ��Ǽ��ԣ�
��4�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�����ӵ��Ӳ�Խ�����Ӱ뾶Խ��A��B��C����Ԫ�ص����Ӱ뾶�ɴ�С��˳��Ϊ��Cl-��Mg2+��Al3+���ʴ�Ϊ��Cl-��Mg2+��Al3+��
���� ���⿼��ṹ����λ�ù�ϵӦ�ã��ƶ�Ԫ���ǽ���ؼ��������ڻ���֪ʶ�Ĺ��̣�

| A�� | NaOH��Һ��FeCl3��Һ | B�� | Na2CO3��Һ��ϡ���� | ||
| C�� | CuSO4��Һ��Ba��OH��2��Һ | D�� | Na2SO4��Һ��MgCl2��Һ |
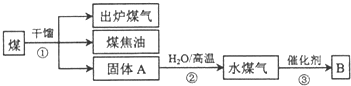
| A�� | ú��ˮú�����Ƕ�����Դ | |
| B�� | ú�к��б����ױ������ױ����л��� | |
| C�� | ���ǽ�ú�ڿ����м�ǿ��ʹ��ֽ�Ĺ��� | |
| D�� | BΪ�״�������ʱ��ԭ�������ʾ��ﵽ100% |
��CS2ΪV�εļ��Է���
��ClO3-�Ŀռ乹��Ϊƽ��������
��SF6����6����ȫ��ͬ�ijɼ����Ӷ�
��SiF4��SO32-������ԭ�Ӿ�Ϊsp3�ӻ���
| A�� | �٢� | B�� | �ڢ� | C�� | �ۢ� | D�� | �٢� |
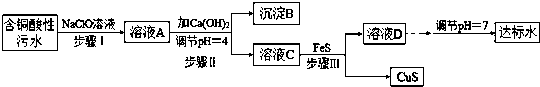
�����Ϣ��
�ٺ�ͭ������ˮ��Ҫ��Ⱦ�����ӣ�����-1��
��-1
| ���� | H+ | Cu2+ | Fe3+ | Fe2+ |
| Ũ��/��mol/L�� | 0.1 | 0.05 | 0.04 | 0.002 |
��FeS������pH��4��������Һ��
��25��ʱ��ijЩ���ܵ���ʵ��ܶȻ���Ksp�� ������-2��
��-2
| ���� | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 | FeS | CuS |
| Kw | 4.0��10-38 | 8.0��10-16 | 2.2��10-20 | 6.4��10-13 | 6.0��10-36 |
��1���ú�ͭ������ˮ��pH=1��
��2�������������������Ҫ��Ӧ�����ӷ���ʽΪ2Fe2++ClO-+2H+=2Fe3++Cl-+H2O��
��3������II�У�������Һ��pH=4��Ŀ��Ϊʹ������ȫ����ֹ��������ֹFeS�ܽ⣮
��4��������Ϊ������II��ֻ�����Ca��OH��2������Һ��pH=7�����ɽ���ˮ�����ɷ��ϱ��Ĵ��ˮ���ù۵㲻���������������������������ͨ������˵������pH=7ʱ��Һ��c��Cu2+��=2.2��10-20�£�10-7��2=2.2��10-6mol•L-1�����ڹ��ҹ涨���ŷű�c��Cu2+����1.0��10-7mol•L-1��
��5������III������������Ҫ��Ӧ�����ӷ���ʽΪCu2++FeS=CuS+Fe2+���ù��̲�ѡ�����ܵ�Na2S������������ԭ�����ΪNa2S�۸������������������ӣ�
��6�������������������У����Ի��յĽ�����������Fe��OH��3��CuS���ѧʽ����

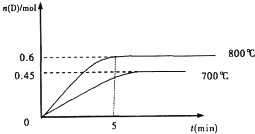 ���ݻ�Ϊ1L���ܱ������У��������·�Ӧ��A��g��+2B��g��?C��g��+D��g�����ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺
���ݻ�Ϊ1L���ܱ������У��������·�Ӧ��A��g��+2B��g��?C��g��+D��g�����ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺