题目内容
6.某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等. 水垢会形成安全隐患,需及时清洗除去.清洗流程如下:Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉.
(1)用NaOH溶解二氧化硅的化学方程式是SiO2+2NaOH═Na2SiO3+H2O.
(2)已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有CaCO3、Mg(OH)2、SiO2.
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因2Fe3++Fe═3Fe2+.
(4)步骤Ⅲ中,加入Na2SO3的目的是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉.(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
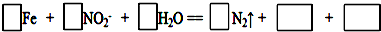
②如果有16.8g铁被钝化,则转移的电子数为4.82×1023(保留三位有效数字).
分析 (1)用NaOH溶解二氧化硅,反应生成硅酸钠和水;
(2)由表格中数据可知,碳酸钙更难溶;
(3)①加入稀盐酸,与碳酸钙、氢氧化镁、铁锈均反应、二氧化硅与HF酸反应;
②溶解的铁锈会加速锅炉腐蚀,发生铁与铁离子的反应;
(4)步骤Ⅲ中,加入Na2SO3,与铁离子发生氧化还原反应;
(5)①由Fe+□NO2-+□H2O═□N2↑,可知Fe元素的化合价升高,N元素的化合价降低,由电子守恒可知,还生成氧化铁,由电荷守恒可知还生成OH-;
②16.8g铁为0.3mol,钝化时表面生成致密的四氧化三铁,根据氧化还原反应方程式进行计算;
解答 解:(1)用NaOH溶解二氧化硅,反应生成硅酸钠和水,反应为SiO2+2NaOH═Na2SiO3+H2O,
故答案为:SiO2+2NaOH═Na2SiO3+H2O;
(2)由表格中数据可知,碳酸钙更难溶,则清洗CaSO4的过程为CaSO4在水中存在平衡CaSO4(s)?Ca2+(aq)+SO42-(aq),用Na2CO3溶液浸泡后,Ca2+与CO32-结合成更难溶的CaCO3,使上述平衡右移,CaSO4转化成CaCO3,然后用盐酸除去,所以步骤Ⅰ中加入Na2CO3可除去水垢中的CaSO4,
故答案为:CaSO4;
(3)①加入稀盐酸,与碳酸钙、氢氧化镁、铁锈均反应,二氧化硅与HF酸反应,则还有CaCO3、Mg(OH)2、SiO2,
故答案为:CaCO3、Mg(OH)2、SiO2;
②溶解的铁锈会加速锅炉腐蚀,发生铁与铁离子的反应,离子反应为2Fe3++Fe═3Fe2+,
故答案为:2Fe3++Fe═3Fe2+;
(4)步骤Ⅲ中,加入Na2SO3,与铁离子发生氧化还原反应,其目的为将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉,反应的离子方程式为SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,
故答案为:SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉;
(5)①由Fe+□NO2-+□H2O═□N2↑,可知Fe元素的化合价升高,N元素的化合价降低,由电子守恒可知,还生成四氧化三铁,由电荷守恒可知还生成OH-,则该反应为
9Fe+8NO2-+4H2O═4N2↑+3Fe3O4+8OH-,
故答案为:9、8、4、4、3Fe3O4、8OH-;
②16.8g铁为0.3mol,钝化时表面生成致密的四氧化三铁,根据氧化还原反应方程式9Fe+8NO2-+4H2O═4N2↑+3Fe3O4+8OH-可知,每9mol铁反应可以转移24mol电子,所以0.3mol铁反应转移的电子数为0.8×6.022×1023=4.82×1023,
故答案为:4.82×1023.
点评 本题考查较综合,涉及混合物分离提纯、溶解平衡及氧化还原反应的配平等,侧重高考高频考点的考查,注意利用铁的性质来解答,题目难度中等.

①CS2为V形的极性分子
②ClO3-的空间构型为平面三角形
③SF6中有6对完全相同的成键电子对
④SiF4和SO32-的中心原子均为sp3杂化.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
| A. | Cl2 | B. | NaOH | C. | H2O | D. | NaClO3 |
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol | 5.00 | 3.5 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为3×10-4mol•(L•s)-1 | |
| B. | 反应达平衡后,往容器中加入5molN2O5气体,平衡正向移动,反应的热效应变大 | |
| C. | 相同温度下,起始时向容器中充入5molNO2和1.25molO2,达到平衡时,NO2的转化率小于50% | |
| D. | 达到平衡后,相同条件下往容器中充入2.5molN2O5和1.25molO2,此时平衡将向右移动 |
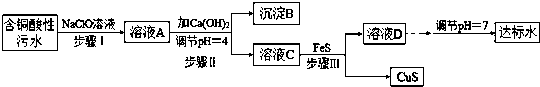
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
表-1
| 离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol/L) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp) (见表-2)
表-2
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Kw | 4.0×10-38 | 8.0×10-16 | 2.2×10-20 | 6.4×10-13 | 6.0×10-36 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤II中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤II中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=2.2×10-20÷(10-7)2=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤III中所发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
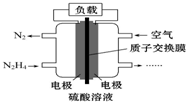 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 负极发生的电极反应式为N2H4-4e-═N2↑+4H+ | |
| C. | 利用该燃料电池工业上可以电解MgCl2溶液制备Mg | |
| D. | 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故c(H+)逐渐减小 |
| A. | 气态氢化物的稳定性:Y>X>W | |
| B. | 四种元素的原子中W原子半径最大 | |
| C. | 四种元素中最高价氧化物的水化物酸性Y最强 | |
| D. | 化合物XY2与ZY2分子中的化学键类型相同 |
| A. | NH${\;}_{4}^{+}$、Cu2+、Cl-、NO${\;}_{4}^{2-}$ | B. | K+、Na+、CO${\;}_{3}^{2-}$、S2- | ||
| C. | K+、Na+、CH3COO-、SO${\;}_{4}^{2-}$ | D. | Ba2+、Mg2+、HCO${\;}_{3}^{-}$、Cl- |