题目内容
15.0.5mol某烃完全燃烧后得到二氧化碳和水蒸气的混合气体.若将该混合气体全部通入盛有足量石灰水的洗气瓶中,洗气瓶内产生白色沉淀100g;若将该混合气体全体通入盛有足量过氧化钠的干燥管,干燥管的质量增加30g.试完成下列问题:(1)该烃的化学式是C2H4
(2)该烃是否为烷烃否(填“是”或“否”),理由是若为烷烃,2个碳原子需要6个H原子饱和.
分析 (1)白色沉淀为CaCO3,根据碳元素守恒计算n(CO2),混合气体通入盛有足量过氧化钠的干燥管,发生反应:2Na2O2+2CO2=O2+2Na2CO3,固体增重相当于与CO2等物质的量的CO的质量,发生反应:2Na2O2+2H2O=4NaOH+O2,固体增重相当于与H2O等物质的量的氢气的质量,根据干燥管质量增重,计算水的物质的量,再根据C、H原子守恒计算烃分子中C、H原子数目,进而确定烃的分子式;
(2)若分子中N(H)=2N(C)+2,则为烷烃.
解答 解:(1)白色沉淀为CaCO3,根据碳元素守恒n(CO2)=n(CaCO3)=$\frac{100g}{100g/mol}$=1mol;
混合气体通入盛有足量过氧化钠的干燥管,发生反应:2Na2O2+2CO2=O2+2Na2CO3,固体增重相当于与CO2等物质的量的CO的质量,即增重为1mol×28g/mol=28g,故过氧化钠与水反应时增重为30g-28g=2g,发生反应:2Na2O2+2H2O=4NaOH+O2,固体增重相当于与H2O等物质的量的氢气的质量,故n(H2O)=n(H2)=$\frac{2g}{2g/mol}$=1mol,
根据原子守恒可知,烃分子中N(C)=$\frac{1mol}{0.5mol}$=2、N(H)=$\frac{1mol×2}{0.5mol}$=4,故该烃的化学式为C2H4,
故答案为:C2H4;
(2)若为烷烃,2个碳原子需要6个H原子饱和,故不属于烷烃,故答案为:否;若为烷烃,2个碳原子需要6个H原子饱和.
点评 本题考查有机物分子式确定的计算,注意利用差量法理解二氧化碳、水与过氧化钠反应固体增重问题,侧重考查学生分析计算能力,难度中等.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
6.若只改变下列中的一个条件,能使N2(g)+3H2(g)?2NH3(g)△H<0平衡向逆反应方向移动的是( )
| A. | 升高温度 | B. | 增大压强 | C. | 增大NH3的浓度 | D. | 使用催化剂 |
3.下列有关电化学原理的说法中,错误的是( )
| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 | |
| C. | 氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 | |
| D. | 可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
10.对于常温下0.1mol•L-1氨水和0.1mol•L-1醋酸,下列说法正确的是( )
| A. | 0.1mol•L-1醋酸,溶液的pH=1 | |
| B. | 0.1mol•L-1醋酸加水稀释,溶液中离子浓度都减小 | |
| C. | 0.1mol•L-1氨水溶液中:c(OH-)=c(NH${\;}_{4}^{+}$) | |
| D. | 0.1mol•L-1氨水与0.1mol•L-1 HCl溶液等体积混合所得溶液中:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) |
20.某混合溶液中可能含有下列离子中的若干种:${NH}_{4}^{+}$、Al3+、Fe2+、Fe3+、${SO}_{4}^{2-}$、${NO}_{2}^{-}$、${NO}_{3}^{-}$、${CO}_{3}^{2-}$,现取三份20mL该溶液于锥形瓶,分别进行如下实验:
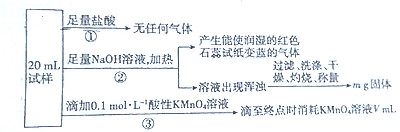
根据上述实验,以下说法不正确的是( )

根据上述实验,以下说法不正确的是( )
| A. | 由实验①可推断原混合溶液中一定不存在${NO}_{2}^{-}$、${CO}_{3}^{2-}$ | |
| B. | 由实验①③可推断原混合溶液中一定存在Fe2+,一定不存在${NO}_{3}^{-}$ | |
| C. | 原混合溶液中肯定存在${NH}_{4}^{+}$、Fe2+、${SO}_{4}^{2-}$ | |
| D. | 如果给出m、V的具体数据,可以确定Al3+、Fe3+是否存在 |
11.下列物质的用途错误的是( )
| A. | 晶体硅是制造太阳能电池的常用材料 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 氢氟酸可用刻蚀玻璃 | |
| D. | 硅是制取水泥的原料 |
 与HCN反应引入:
与HCN反应引入: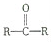 $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$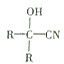
 $→_{一定条件①}^{HCN}$ A $→_{②}^{H_{2}O,H+}$ B$→_{③}^{浓H_{2}SO_{4},△}$ C $→_{催化剂④}^{聚合}$ D
$→_{一定条件①}^{HCN}$ A $→_{②}^{H_{2}O,H+}$ B$→_{③}^{浓H_{2}SO_{4},△}$ C $→_{催化剂④}^{聚合}$ D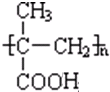 .
.