题目内容
3.下列有关电化学原理的说法中,错误的是( )| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 | |
| C. | 氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 | |
| D. | 可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
分析 A、电化学腐蚀比化学腐蚀快;
B、在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极;
C、氯碱工业,是电解饱和的氯化钠溶液来制取工业上重要的化工原料烧碱和氯气;
D、“二次电池”在充电时是电解池原理,在放电时,是原电池原理.
解答 解:A.电化学腐蚀加速负极金属被腐蚀,比化学腐蚀快,危害更大,故A不选;
B、在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极,电解质是含有铜离子的盐溶液,故B不选;
C、氯碱工业是电解饱和氯化钠溶液来制取工业上重要的化工原料烧碱和氯气,电解熔融的氯化钠可以获得金属钠和氯气,故C选;
D、“二次电池”在充电时是电解池原理,是将电能转变成化学能,在放电时,是原电池原理,又将化学能转化成电能,故D不选.
故选C.
点评 本题涉及原电池和电解池的工作原理以及金属的腐蚀和防护知识,属于综合知识的考查,难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
13.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
11.氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g)$?_{△}^{催化剂}$2NH3(g),△H<0
①该反应的平衡常数K的表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.升高温度,K值减小(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,200℃、100MPa(填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是压强太高生产设备条件难以实现.
③下列关于合成氨说法正确是B(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式2NH3-6e-+6OH-=N2+3H2O.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g)$?_{△}^{催化剂}$2NH3(g),△H<0
①该反应的平衡常数K的表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.升高温度,K值减小(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,200℃、100MPa(填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是压强太高生产设备条件难以实现.
氨的平衡(MP)含量%压强温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式2NH3-6e-+6OH-=N2+3H2O.
18.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示.下列说法正确的是( )


| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |
8.一定量CH4不完全燃烧得到49.6g CO2、CO和水蒸气的混合气体,让其通过浓H2SO4时浓硫酸增重25.2g,则混合气体中CO2的质量为( )
| A. | 12.5g | B. | 13.2g | C. | 19.7g | D. | 24.4g |
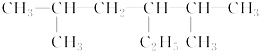 的名称是2,5-二甲基-3-乙基己烷
的名称是2,5-二甲基-3-乙基己烷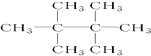 名称是2,2,3,3-四甲基丁烷.
名称是2,2,3,3-四甲基丁烷.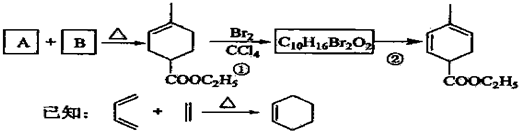
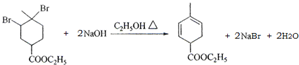 .
.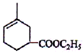 .
.