题目内容
20.某混合溶液中可能含有下列离子中的若干种:${NH}_{4}^{+}$、Al3+、Fe2+、Fe3+、${SO}_{4}^{2-}$、${NO}_{2}^{-}$、${NO}_{3}^{-}$、${CO}_{3}^{2-}$,现取三份20mL该溶液于锥形瓶,分别进行如下实验: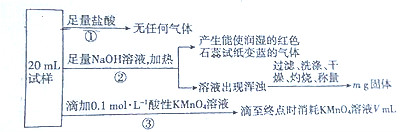
根据上述实验,以下说法不正确的是( )
| A. | 由实验①可推断原混合溶液中一定不存在${NO}_{2}^{-}$、${CO}_{3}^{2-}$ | |
| B. | 由实验①③可推断原混合溶液中一定存在Fe2+,一定不存在${NO}_{3}^{-}$ | |
| C. | 原混合溶液中肯定存在${NH}_{4}^{+}$、Fe2+、${SO}_{4}^{2-}$ | |
| D. | 如果给出m、V的具体数据,可以确定Al3+、Fe3+是否存在 |
分析 ①向第一份试样中加入足量的盐酸,无任何气体生成,说明溶液中无NO2-和CO32-;
②向第二份试样中加入足量的额氢氧化钠溶液然后加热,有使红色石蕊试纸变蓝的气体产生,则气体为NH3,说明原溶液中有NH4+; 溶液出现浑浊,说明溶液中有Fe2+、Fe3+中的一种或两者均有,但无论含的是Fe2+还是Fe3+,沉淀后经过滤、洗涤、干燥、灼烧后所得的mg固体均为Fe2O3;
③向第三份溶液中加入KMnO4溶液进行滴定,说明溶液中一定含Fe2+,而既然含Fe2+,在向溶液中加盐酸时却无任何气体生成,说明溶液中一定无NO3-,而根据溶液要呈电中性可知,溶液中一定含SO42-,据此分析.
解答 解:①向第一份试样中加入足量的盐酸,无任何气体生成,说明溶液中无NO2-和CO32-;
②向第二份试样中加入足量的额氢氧化钠溶液然后加热,有使红色石蕊试纸变蓝的气体产生,则气体为NH3,说明原溶液中有NH4+; 溶液出现浑浊,说明溶液中有Fe2+、Fe3+中的一种或两者均有,但无论含的是Fe2+还是Fe3+,沉淀后经过滤、洗涤、干燥、灼烧后所得的mg固体均为Fe2O3;
③向第三份溶液中加入KMnO4溶液进行滴定,说明溶液中一定含Fe2+,而既然含Fe2+,在向溶液中加盐酸时却无任何气体生成,说明溶液中一定无NO3-,而根据溶液要呈电中性可知,溶液中一定含SO42-,据此分析.
即溶液中一定含NH4+、Fe2+、SO42-,一定不含NO3-、NO2-和CO32-,不能确定的是Al3+、Fe3+.
A、加入足量的盐酸,无任何气体生成,说明溶液中无NO2-和CO32-,故A正确;
B、溶液中一定含NH4+、Fe2+、SO42-,一定不含NO3-、NO2-和CO32-,故B正确;
C、溶液中一定含NH4+、Fe2+、SO42-,故C正确;
D、根据消耗的KMnO4溶液的量为V×10-4mol,可知Fe2+的物质的量n=5V×10-4mol,所得的mg固体均为Fe2O3,根据铁元素的守恒可求出Fe3+的物质的量n=$\frac{m}{160}×2mol-5V×1{0}^{-4}mol$=$(\frac{m}{80}-5V×1{0}^{-4})$mol,但求不出Al3+的物质的量,故D错误.
故选D.
点评 本题考查了离子的检验和有关离子量的求算,应注意的是无论是Fe2+还是Fe3+,在沉淀后经过过滤、洗涤、干燥、灼烧后所得的固体均为Fe2O3.

| A. | 乙酸乙酯和水,酒精和脂肪,苯和汽油 | |
| B. | 油脂和水,溴苯和水,硝基苯和水 | |
| C. | 甲醛和水,蚁酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和甲苯,鸡蛋白和水 |
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g)$?_{△}^{催化剂}$2NH3(g),△H<0
①该反应的平衡常数K的表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.升高温度,K值减小(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,200℃、100MPa(填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是压强太高生产设备条件难以实现.
氨的平衡(MP)含量%压强温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式2NH3-6e-+6OH-=N2+3H2O.
| A. | 12.5g | B. | 13.2g | C. | 19.7g | D. | 24.4g |
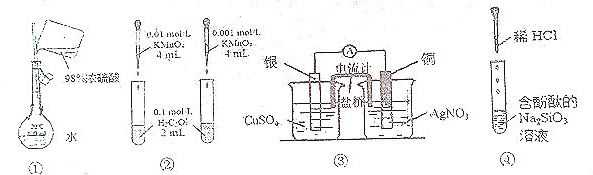
| A. | 装置①配制一定的物质的量浓度的稀硫酸溶液 | |
| B. | 装置②根据溶液褪色的快慢比较浓度对反应速率的影响 | |
| C. | 装置③制作原电池 | |
| D. | 装置④制备硅胶 |
| A. | 该反应的正反应为放热反应 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 反应的热化学方程式可表示为:CO(g)+H2O(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO2(g)+H2(g)△H<0 kJ/mol |