题目内容
5. 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.(1)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为5ClO2-+4H+=4ClO2↑+Cl-.向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快.产生气体速率迅速加快的原因是:反应生成的氯离子对该反应起催化作用.
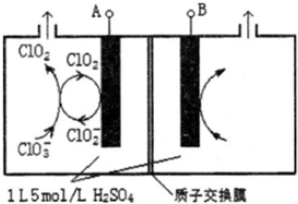
(2)电解法是目前研究最为热门的生产ClO2的方法之一.如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验.
①电源负极为A极(填A或B):
②写出阴极室发生反应依次为:ClO2+e-=ClO2-、ClO3-+ClO2-+2H+=2ClO2↑+H2O;
(3)已知:
2SO2(g)+O2(g)?2SO3 (g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2 (g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H==-41.8kJ•mol-1
在一定的条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,测得上述反应平衡时的NO2与SO2体积之比为1:6,则平衡常数K=$\frac{8}{3}$.
分析 (1)反应物为亚氯酸钠,所在环境为酸性环境,生成物为ClO2气体,且知此反应为歧化反应,据此书写离子反应方程式即可;改加pH相同的硫酸,氢离子浓度不变,应考虑氯离子的影响;
(2)①与电源负极相连的一极为阳极,溶液中的阳离子在此电极得到电子,发生还原反应;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2;
(3)2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1 (i),2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1(ii),[(i)-(ii)]÷2得目标方程式,利用三段法计算平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,据此解答即可.
解答 解:(1)亚氯酸钠在强酸性溶液中会发生歧化反应,产生ClO2气体,故化合价由+3价升高到+4价,故部分氯离子降低为-1价,离子反应方程式为:5ClO2-+4H+=4ClO2↑+Cl-,反应开始时,溶液中氯离子浓度很小,随着反应的进行,溶液中氯离子浓度增大,反应速率加快,可见氯离子起催化作用,
故答案为:5ClO2-+4H+=4ClO2↑+Cl-;反应生成的氯离子对该反应起催化作用;
(2)①由图可知,ClO2在电极A上得到1个电子,生成ClO2-,故A应为电源的负极,故答案为:A;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2,离子反应方程式为:ClO3-+ClO2-+2H+=2ClO2↑+H2O,
故答案为:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O;
(3)2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1 (i),2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1(ii),[(i)-(ii)]÷2得:NO2(g)+SO2 (g)?SO3 (g)+NO(g),故△H=$\frac{-196.6-(-113.0)}{2}$=-41.8(KJ/mol),
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x=$\frac{4}{5}$a,故平衡常数K=$\frac{c(S{O}_{3})c(NO)}{c(N{O}_{2})c(S{O}_{2})}$=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{\frac{16}{25}{a}^{2}}{\frac{1}{5}a×\frac{6}{5}a}$=$\frac{8}{3}$,
故答案为:-41.8;$\frac{8}{3}$.
点评 本题以NO2、SO2、CO等物质为载体,综合考查化学平衡移动、盖斯定律以及平衡常数的计算等问题,侧重于学生综合运用化学知识的能力的考查,题目难度中等.

| A. | 该氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-)的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
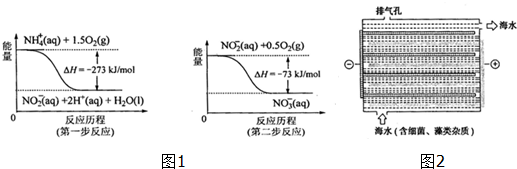
Ⅰ.饮用水中含所有一定浓度的NO3+将对人体健康产生危害,NO3+能氧化人体血红蛋白中的Fe(H),使其失去携氧功能.
(1)饮用水中的NO3+主要来自NO4+.已知在微生物作用下,NO4+经过两步反应被氧化成NO3+.两步反应的能量变化示意图如图1,试写出1molNO4+(ap)全部氧化成NO3+(ap)的热化学方程式NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ•mol-1.
(2)用H2催化还原法也可见底饮用水中NO3+的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-.
(3)现测得某地水质试样中所含水溶性无机离子的化学组及其平均浓度如下表:根据表中数据计算该试样的pH=4
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
(1)通常用明矾[K2SO4•Al2(SO4)3•24H2O]作混凝剂,降低浊度.明矾水解的离子方程式是Al3++3H2O?Al(OH)3(胶体)+3H+.
(2)对海水进行消毒和灭藻处理时常用如图2所示NaClO的发生装置.
①装置中由NaCl转化为NaClO的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O.
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3.生成CaCO3的离子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O.
③若每隔5-10min倒换一次电极电性,可有效地解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.

| A. | 由Zn和稀H2SO4反应制取氢气 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | D. | 碳酸钙的分解 |
| A. | 2015年3月5日,李克强总理在政府工作报告中说:“生态环保贵在行动、成在坚持,要求全年能耗强度下降3.1%以上”,从源头上消除污染,这符合“绿色化学”的理念 | |
| B. | 农业废弃物、水生植物、油料植物、城市与工业有机废弃物、动物粪便等均蕴藏着丰富的生物质能 | |
| C. | 硅藻泥材料具有很好的吸音降噪、净化空气、防霉防潮等性能,已成为当下时兴的环保装修材料,硅藻泥主要原材料为硅藻上,成分是SiO2,拥有多空的结构,具有强吸附性 | |
| D. | 把粉末状的氢化钛泡沫剂添加到熔融的金属铝中,冷却后可得到某种金属泡沫,利用该金属泡沫具有强度低、质量轻等特性可用于建造海上漂浮城市. |
| A. | 0.1mol•L-1CH3COOH与0.1mol•L-1氨水等体积混合(PH=7):c(NH4+)=c(CH3COO-)=c(H+)=c(OH-) | |
| B. | 0.1mol•L-1HCl溶液与0.2mol•L-1氨水等体积混合(PH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| C. | 0.1mol•L-1CH3COONa与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1 NaHCO3溶液等体积混合:c(HCO3-)>0.05mol•L-1>c(CO32-)>c(OH-) |
| A. | 加热氯化铁溶液,溶液颜色变深与盐类水解有关 | |
| B. | NaHS溶液水解方程式为:HS-+H2O?H2S+OH- | |
| C. | Na2SO3溶液中,c(OH-)=c(H+)+c(HSO3-)+c(H2SO3) | |
| D. | 0.1 mol•L-1的CH3COOH溶液和0.1 mol•L-1的CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )| A. | a、b、c三点溶液的Kw相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
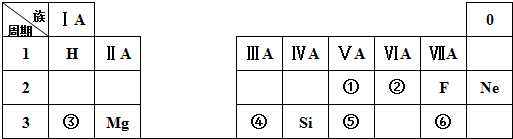
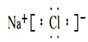 .
.