题目内容
17.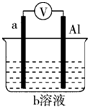 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.(1)若a为镁、b为CuCl2,则正极材料为Al
(2)若a为镁、b为NaOH,负极上的电极反应式为Al-3e-+4OH-═AlO2-+2H2O.
(3)若a为铜、b为浓硝酸,正极上的电极反应式为2H++NO3-+e-═H2O+NO2↑.
(4)碱性条件下氢氧燃料电池的电极反应:负极反应式2H2+4OH--4e-=4H2O,正极反应式O2+2H2O+4e-=4OH-.
分析 (1)若a为镁、b为CuCl2,则镁比铝活泼,负极为镁发生氧化反应,正极材料为铝发生还原反应;
(2)若a为镁、b为NaOH,则铝在碱中比镁活泼,负极为铝发生氧化反应,正极材料为镁发生还原反应;
(3)若a为铜、b为浓硝酸,铝与浓硝酸发生钝化,则铜为负极发生氧化反应,铝为正极发生还原反应,电流的方向为正极到负极;
(4)碱性条件下氢氧燃料电池负极氢气失电子与氢氧根结合生成水,正极氧气得电子生成氢氧根.
解答 解:(1)若a为镁、b为CuCl2,则镁比铝活泼,负极为镁发生氧化反应,反应式为:Mg-2e-═Mg2+,正极材料为铝发生还原反应,故答案为:Al;
(2)若a为镁、b为NaOH,则铝在碱中比镁活泼,负极为铝发生氧化反应,反应式为:Al-3e-+4OH-═AlO2-+2H2O,正极材料为镁发生还原反应,故答案为:Al-3e-+4OH-═AlO2-+2H2O;
(3)若a为铜、b为浓硝酸,铝与浓硝酸发生钝化,则铜为负极发生氧化反应,铝为正极发生还原反应反应式为:2H++NO3-++e-═H2O+NO2↑,电流的方向为正极铝到负极铜,故答案为:2H++NO3-+e-═H2O+NO2↑;
(4)碱性条件下氢氧燃料电池负极氢气失电子与氢氧根结合生成水,反应式为:2H2+4OH--4e-=4H2O,正极氧气得电子生成氢氧根,反应式为;O2+2H2O+4e-=4OH-,故答案为:2H2+4OH--4e-=4H2O;O2+2H2O+4e-=4OH-.
点评 本题考查原电池的组成和工作原理,题目难度不大,注意把握以镁、铝为电极材料,电解质溶液的酸碱性不同,电极反应不同,为易错点.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
5.25℃时,下列各溶液中关系的叙述中,正确的是( )
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c (Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | pH=2的盐酸与pH=l的硫酸溶液中c(H+)之比为2:1 | |
| C. | 0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-)=0.1 mol/L,则BA(盐)溶液pH<7 | |
| D. | 4种pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH中c(Na+)的大小顺序是④>①>②>③ |
12.把2.1g CO与H2组成的混合气体与足量的O2充分燃烧后,立即将产物全部通入到足量的Na2O2固体中,则固体的质量增加了( )
| A. | 2.1 g | B. | 3.6 g | C. | 7.2 g | D. | 无法确定 |
2.下列各项中的两个量,其比值一定为1:2的是( )
| A. | 固体Na2O2中阴离子与阳离子的个数 | |
| B. | 相同温度下100ml 0.1mol/L CH3COOH与100ml 0.2mol/L CH3COOH溶液的c(H+) | |
| C. | 液面在“0”刻度时,25ml碱式滴定管和50ml碱式滴定管所盛溶液的体积 | |
| D. | 在反应2H2S+SO2=3S↓+2H2O中氧化产物与还原产物的质量 |
6.下列实验能达到目的是( )
| A. | 用Cu与浓硝酸反应制NO2 | |
| B. | 用饱和NaHCO3溶液除去混在Cl2中的HCl气体 | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液以制备Al(OH)3 | |
| D. | 用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 |
 .
. .
. 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).