题目内容
8.实验室里要配制465mL 0.2mol/L的硫酸钠溶液.(1)请填写下列空白:
A.计算、称量、溶解:在天平上称出14.2g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解.
B.转移:把得到的溶液冷却后小心地沿着玻璃棒注入500mL容量瓶中.
C.洗涤:用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中.
D.定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2cm,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切.
E.摇匀:将瓶塞塞紧,充分摇匀.
F.贴标签、装试剂瓶:将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶.
(2)下列情况会使所配溶液浓度偏高的是ae(填字母).
a.某同学定容时俯时容量瓶刻度线
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线又加水了
d.进行B操作时将少量液体洒到外面
e.未冷却至室温就进行转移.
分析 (1)A、由于实验室无465mL容量瓶,故应选用500mL容量瓶,配制出500mL溶液,根据质量m=CVM计算所需的硫酸钠的质量;
B、移液时,用玻璃棒引流;
D、定容时,开始直接将水倒入容量瓶,后改用胶头滴管逐滴加入;
(2)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
解答 解:(1)A、由于实验室无465mL容量瓶,故应选用500mL容量瓶,配制出500mL溶液,所需硫酸钠的质量m=CVM=0.2mol/L×0.5L×142g/mol=14.2g,故答案为:14.2;
B、移液时,用玻璃棒引流,将溶液注入500mL容量瓶,故答案为:玻璃棒;500mL容量瓶;
D、定容时,开始直接将水倒入容量瓶,后改用胶头滴管逐滴加入,至凹液面与刻度线相切,故答案为:胶头滴管;
(2)a.某同学定容时俯时容量瓶刻度线,则溶液体积偏小,故浓度偏高,故a正确;
b.没有进行上述的操作步骤C,会导致溶质的损失,则浓度偏低,故b错误;
c.摇匀后发现液面低于刻度线是正常的,又加水会导致浓度偏低,故c错误;
d.进行B操作时将少量液体洒到外面,会导致溶质的损失,则浓度偏低,故d错误;
e.未冷却至室温就进行转移,待冷却后溶液体积偏小,浓度偏高,故e正确.
故答案为:ae.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 14C与 12C互称同位素;O2与O3是氧元素的同素异形体 | |
| B. | 钢铁生锈主要发生吸氧腐蚀,镀锌铁皮镀层破损后对铁失去保护作用 | |
| C. | 石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 | |
| D. | SO2和NO2属于酸性氧化物,Na2O和Fe3O4属于碱性氧化物 |
19.几种短周期元素的原子半径及常见化合价见表:
请分析上表中有关数据,并结合已学知识,回答以下问题(涉及上述元素的答案,请用元素符号表示):
(1)E元素在周期表中位置是第二周期IA族.
(2)A、H、J对应离子的半径由大到小的顺序是F->Na+>Al3+(填离子符号)
(3)A与J所形成的化合物中含有离子键(填“离子”或“共价”)
(4)写出DB2的电子式: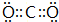 .
.
(5)写出D的最高价氧化物与J的最高价氧化物对应水化物X的溶液(足量)发生反应的离子方程式:CO2+OH-=HCO3-.
| 元素代号 | A | B | C | D | E | F | G | H | I | J | K |
| 常见化合价 | -1 | -2 | +5、-3 | +4、-4 | +6、+4、-2 | +4、-4 | +5、-3 | +3 | +2 | +1 | +1 |
| 原子半径/pm | 71 | 74 | 75 | 77 | 102 | 117 | 110 | 143 | 160 | 186 | 152 |
(1)E元素在周期表中位置是第二周期IA族.
(2)A、H、J对应离子的半径由大到小的顺序是F->Na+>Al3+(填离子符号)
(3)A与J所形成的化合物中含有离子键(填“离子”或“共价”)
(4)写出DB2的电子式:
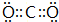 .
.(5)写出D的最高价氧化物与J的最高价氧化物对应水化物X的溶液(足量)发生反应的离子方程式:CO2+OH-=HCO3-.
16.用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是( )
| A. | Cu $\stackrel{浓硝酸}{→}$ Cu(NO3)2 | B. | Cu$\stackrel{AgNO_{3}}{→}$ Cu(NO3)2 | ||
| C. | Cu $\stackrel{Cl_{2}}{→}$ CuCl2$\stackrel{稀硝酸}{→}$Cu(NO3)2 | D. | Cu$\stackrel{空气}{→}$ CuO $\stackrel{HNO_{3}}{→}$ Cu(NO3)2 |
3.科学家冶炼出了纯度高达99.9999%的铁,你估计它不会具有的性质是( )
| A. | 在潮湿的空气中放置不易生锈 | B. | 硬度比生铁大 | ||
| C. | 与2mol/L盐酸的反应生成氢气 | D. | 在冷的浓H2SO4溶液中可钝化 |
13.X、Y、Z、W为四种短周期主族元素.其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A. | X与W形成化合物稳定性一定强于Z与W形成化合物 | |
| B. | Y、Z两元素的简单离子半径Y>Z | |
| C. | X、Y、Z对应气态氢化物的热稳定性和还原性强弱顺序一致 | |
| D. | Y元素最高价氧化物对应水化物的化学式为HYO4 |
20.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
| A. | C14H18O5 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H10O5 |
18.有机化学主要研究有机化合物所发生的反应,下列化合物中不属于有机物的是( )
| A. | NH4CNO | B. | CH4 | C. | 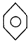 | D. | CH3CH2OH |
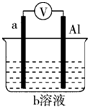 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.