题目内容
2.下列各项中的两个量,其比值一定为1:2的是( )| A. | 固体Na2O2中阴离子与阳离子的个数 | |
| B. | 相同温度下100ml 0.1mol/L CH3COOH与100ml 0.2mol/L CH3COOH溶液的c(H+) | |
| C. | 液面在“0”刻度时,25ml碱式滴定管和50ml碱式滴定管所盛溶液的体积 | |
| D. | 在反应2H2S+SO2=3S↓+2H2O中氧化产物与还原产物的质量 |
分析 A.过氧化钠由钠离子与过氧根离子构成;
B.醋酸溶液的浓度越大,其电离程度越小;
C.滴定管最大数值下面还有溶液,其体积未知;
D.反应2H2S+SO2=3S↓+2H2O中氧化产物S与还原产物S的物质的量之比为2:1.
解答 解:A.固体Na2O2中阴离子O2-与阳离子Na+的个数1:2,故A正确;
B.相同温度下0.lmol/L的CH3COOH与0.2mol/L的CH3COOH溶液中,醋酸的电离程度不同,所以的c(H+)之比不是1:2.故B错误;
C.25mL滴定管和50mL滴定管的管径不同,滴定管刻度线下没有刻度,但充满液体,所以体积不是1:2,故C错误;
D.反应2H2S+SO2→3S↓+2H2O中氧化产物S与还原产物S的物质的量之比为2:1,则质量比为2:1,故D错误;
故选A.
点评 本题考查较为综合,涉及物质组成、滴定管的构造、弱电解质的电离、氧化还原反应等问题,综合考查学生的分析理解能力,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.X、Y、Z、W为四种短周期主族元素.其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A. | X与W形成化合物稳定性一定强于Z与W形成化合物 | |
| B. | Y、Z两元素的简单离子半径Y>Z | |
| C. | X、Y、Z对应气态氢化物的热稳定性和还原性强弱顺序一致 | |
| D. | Y元素最高价氧化物对应水化物的化学式为HYO4 |
7.下列关于物质的量的叙述中,正确的是( )
| A. | 1 mol任何物质都含有6.02×1023个分子 | |
| B. | 12g 12C中含有约6.02×1023个碳分子 | |
| C. | 1 mol水中含有2 mol氢元素和1 mol氧元素 | |
| D. | 1 mol Ne中含有约6.02×1024个电子 |
14.合金是一类用途广泛的金属材料.下列物质中,不属于合金的是( )
| A. | 碳素钢 | B. | 水银 | C. | 青铜 | D. | 黄铜 |
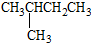
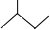
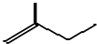 C5H10
C5H10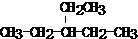
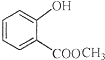 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基. ,氧元素在周期中的位置是第二周期第ⅥA族
,氧元素在周期中的位置是第二周期第ⅥA族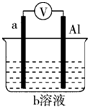 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题. 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则V2为( )
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则V2为( )