题目内容
12.把2.1g CO与H2组成的混合气体与足量的O2充分燃烧后,立即将产物全部通入到足量的Na2O2固体中,则固体的质量增加了( )| A. | 2.1 g | B. | 3.6 g | C. | 7.2 g | D. | 无法确定 |
分析 利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.
2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2═2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;
2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2═4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量.
解答 解:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应,
2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2═2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;
2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2═4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,
故过氧化钠固体增重等于CO和H2的质量之和为2.1g,
故选A.
点评 本题考查混合物反应的计算,题目难度中等,注意从CO2、H2O与Na2O2生成固体质量的变化分析规律,是解答该题的关键,试题培养了学生的灵活应用能力.

| A. | 在潮湿的空气中放置不易生锈 | B. | 硬度比生铁大 | ||
| C. | 与2mol/L盐酸的反应生成氢气 | D. | 在冷的浓H2SO4溶液中可钝化 |
| A. | C14H18O5 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H10O5 |
| A. | 64 g SO2含有氧原子数为NA | |
| B. | 1 mol铁与足量稀盐酸反应转移的电子数目为3 NA | |
| C. | 在同温同压下,相同体积的任何气体单质应含有相同的原子数 | |
| D. | 常温常压下,14 g N2含有分子数为0.5 NA |
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液刻蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 铜溶于酸化的H2O2溶液:Cu+2H++H2O2═Cu2++2H2O | |
| D. | Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O═2Al(OH)3+3H2↑ |
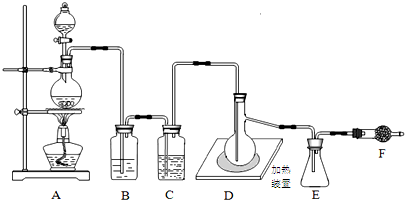
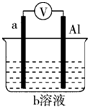 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.