题目内容
9.用实验确定某酸HA是弱电解质.两同学的方案是:甲:①称取一定质量的HA配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质.
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入长度相同的镁条(已除去表面的氧化膜),观察现象,即可证明HA是弱电解质.
(1)在两个方案的第①步中,都要用到的定量仪器是100mL的容量瓶.
(2)用pH试纸测定溶液pH的正确操作是a
a.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
b.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测点在试纸上,再与标准比色卡对照
c.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
d.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
(3)甲方案中,说明HA是弱电解质的理由是测得溶液的pH>1(选填>、<、=).
乙方案中,说明HA是弱电解质的现象是b.(多选扣分)
a.装HCl溶液的试管中放出H2的速率快;
b.装HA溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快.
(4)请你评价:乙方案中难以实现之处配制pH=1的HA溶液难以实现,加入锌粒难以做到表面积相同.
分析 (1)配制一定物质的量浓度的溶液需要容量瓶;
(2)用pH试纸测定溶液pH时,pH不能润湿,不能将试纸直接在待测液中蘸,据此分析;
(3)弱酸在水溶液里部分电离,所以氢离子浓度小于酸浓度;酸和锌反应时生成氢气,反应速率和氢离子浓度成正比,根据生成氢气的反应速率确定酸的强弱;
(4)弱酸存在电离平衡,锌粒大小难以控制
解答 解:(1)在两个方案的第①步中,配制0.1mol/L的溶液100mL、配制pH=1的两种酸溶液各100mL,根据配制一定浓度的溶液知必须使用容量瓶,故答案为:100mL的容量瓶;
(2)用pH试纸测定溶液pH时,pH不能润湿,否则会对待测液造成稀释,不能将试纸直接在待测液中蘸,否则会对溶液造成污染,故选a;
(3)弱酸在水溶液里部分电离,所以氢离子浓度小于酸浓度,如果该酸是弱酸,则0.1mol/L的HA溶液的pH>1;pH相等的一元酸,弱酸的浓度大于强酸,等体积等PH的醋酸和盐酸稀释相同倍数时,醋酸中氢离子浓度大于盐酸,分别和锌反应时,弱酸生成氢气的反应速率大于强酸,故选b,
故答案为:>;b;
(3)HA是弱酸存在电离平衡,所以配制pH=1的HA溶液难以实现,反应物的接触面积与反应速率成正比,锌粒的表面积大小难以控制,所以实现较困难,
故答案为:配制pH=1的HA溶液难以实现,加入锌粒难以做到表面积相同.
点评 注意电解质的强弱是根据其电离程度划分的,不能根据溶液的导电能力划分的,为易错点.

练习册系列答案
相关题目
19.几种短周期元素的原子半径及常见化合价见表:
请分析上表中有关数据,并结合已学知识,回答以下问题(涉及上述元素的答案,请用元素符号表示):
(1)E元素在周期表中位置是第二周期IA族.
(2)A、H、J对应离子的半径由大到小的顺序是F->Na+>Al3+(填离子符号)
(3)A与J所形成的化合物中含有离子键(填“离子”或“共价”)
(4)写出DB2的电子式: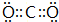 .
.
(5)写出D的最高价氧化物与J的最高价氧化物对应水化物X的溶液(足量)发生反应的离子方程式:CO2+OH-=HCO3-.
| 元素代号 | A | B | C | D | E | F | G | H | I | J | K |
| 常见化合价 | -1 | -2 | +5、-3 | +4、-4 | +6、+4、-2 | +4、-4 | +5、-3 | +3 | +2 | +1 | +1 |
| 原子半径/pm | 71 | 74 | 75 | 77 | 102 | 117 | 110 | 143 | 160 | 186 | 152 |
(1)E元素在周期表中位置是第二周期IA族.
(2)A、H、J对应离子的半径由大到小的顺序是F->Na+>Al3+(填离子符号)
(3)A与J所形成的化合物中含有离子键(填“离子”或“共价”)
(4)写出DB2的电子式:
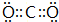 .
.(5)写出D的最高价氧化物与J的最高价氧化物对应水化物X的溶液(足量)发生反应的离子方程式:CO2+OH-=HCO3-.
20.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为( )
| A. | C14H18O5 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H10O5 |
14.合金是一类用途广泛的金属材料.下列物质中,不属于合金的是( )
| A. | 碳素钢 | B. | 水银 | C. | 青铜 | D. | 黄铜 |
1.下列解释事实的离子方程式不正确的是( )
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液刻蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 铜溶于酸化的H2O2溶液:Cu+2H++H2O2═Cu2++2H2O | |
| D. | Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O═2Al(OH)3+3H2↑ |
18.有机化学主要研究有机化合物所发生的反应,下列化合物中不属于有机物的是( )
| A. | NH4CNO | B. | CH4 | C. | 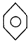 | D. | CH3CH2OH |
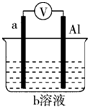 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.