题目内容
13.如表是部分短周期元素的原子半径及主要化合价.| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.037 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)①和⑧能形成原子个数比1:1和2:1的化合物,原子个数比为1:1的化合物中存在的化学键:离子键和非极性共价键.
(2)写出由2个⑦的原子和4个③的原子构成的物质的电子式:
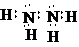
(3)写出④的最高价氧化物对应水化物与①的最高价氧化物对应水化物的水溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)下列叙述正确的是ABCD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑧在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
(5)①、⑥、⑧可以形成多种盐,其中一种盐中①、⑥、⑧三种元素的原子个数比为1:1:1,该盐的名称为次氯酸钠.它的水溶液与⑥的氢化物的水溶液反应可生成⑥的单质,该反应的离子方程式为ClO-+2H++Cl-═Cl2↑+H2O.
分析 在第二、三周期元素中,主族元素的最高化合价与其族序数相等,故①③为第ⅠA族,⑤⑦为第ⅤA族,②为第ⅡA族,同一主族元素,原子半径随着原子序数增大而增大,所以在⑤⑦中,⑤是P元素,⑦是N元素,在①③中,①的半径最大,所以①是Na元素,③的半径小于氮,所以③是H元素,由于②的半径小于①大于⑤,所以②是Mg元素,④为第ⅢA族,半径小于镁元素大于磷元素,所以④是Al元素,⑥为第ⅤⅡA族,半径小于磷而大于氮,所以⑥是Cl元素,⑧为第ⅥA族,半径小于氮元素,所以⑧是O元素,故①是Na元素、②Mg元素、③是H元素、④是Al元素、⑤是P元素、⑥是Cl元素、⑦是N元素、⑧是O元素,据此答题.
解答 解:在第二、三周期元素中,主族元素的最高化合价与其族序数相等,故①③为第ⅠA族,⑤⑦为第ⅤA族,②为第ⅡA族,同一主族元素,原子半径随着原子序数增大而增大,所以在⑤⑦中,⑤是P元素,⑦是N元素,在①③中,①的半径最大,所以①是Na元素,③的半径小于氮,所以③是H元素,由于②的半径小于①大于⑤,所以②是Mg元素,④为第ⅢA族,半径小于镁元素大于磷元素,所以④是Al元素,⑥为第ⅤⅡA族,半径小于磷而大于氮,所以⑥是Cl元素,⑧为第ⅥA族,半径小于氮元素,所以⑧是O元素,故①是Na元素、②Mg元素、③是H元素、④是Al元素、⑤是P元素、⑥是Cl元素、⑦是N元素、⑧是O元素,
(1)①和⑧能形成原子个数比1:1和2:1的化合物,原子个数比为1:1的化合物为Na2O2,其中存在的化学键为离子键和非极性共价键,
故答案为:离子键和非极性共价键;
(2)由2个⑦的原子和4个③的原子构成的物质为N2H4,它的电子式为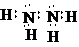
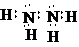
(3)④的最高价氧化物对应水化物为Al(OH)3,①的最高价氧化物对应水化物为NaOH,它们的水溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)A.③是H元素,位于第一周期,④是Al元素处于第三周期,故A正确;
B.Mg离子与氧离子的核外都有10个电子,故B正确;
C.氧在同主族元素中非金属性最强,故C正确;
D.⑤是P元素素与⑦N元素,两者核电荷数之差是8,故D正确;
故答案为:ABCD;
(5)①、⑥、⑧可以形成的盐中原子个数比为1:1:1,该盐的名称为次氯酸钠,它的水溶液与氯化氢的水溶液反应可生成⑥的单质,该反应的离子方程式为ClO-+2H++Cl-═Cl2↑+H2O,
故答案为:次氯酸钠; ClO-+2H++Cl-═Cl2↑+H2O.
点评 本题考查了原子结构和元素周期律的关系,正确推断元素是解本题关键,明确元素周期律的灵活运用,难度不大.

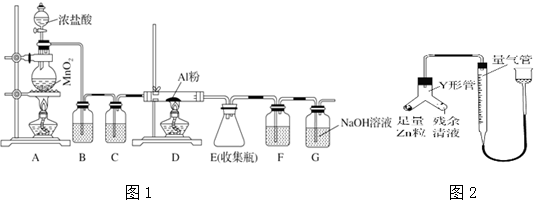
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).(1)实验前,应先检查装置的气密性;实验中产生的尾气应通人NaOH溶液.
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶.
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色.
【查阅资料】Fe( HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO${\;}_{4}^{2-}$.Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:
| 步骤② | 往5mL 1mol•LFeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热在较短时间内溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.短时间内发现溶液颜色变成浅绿色. |
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
| A. | 氢气通过灼热的CuO粉末 | B. | 碳与SiO2高温反应制粗硅 | ||
| C. | 将锌粒投入Cu(NO3)2溶液 | D. | 镁条在CO2中燃烧 |
| A. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5 NA | |
| B. | 14g乙烯和丙烯的混合物中总原子数为3 NA | |
| C. | 标准状况下,22.4 L氯仿中含有的氯原子数目为3 NA | |
| D. | 17.6 g丙烷中所含的极性共价键为4 NA |
| A. | 一CH3(甲基)的电子式为 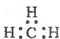 | B. | 硝基苯的结构简式: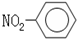 | ||
| C. | 甲醛的结构式: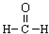 | D. | 乙醇的分子式:CH3CH2OH |
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 根据化学反应速率的大小可以知道化学反应的相对快慢 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
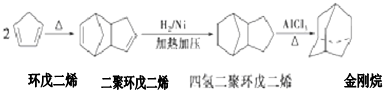
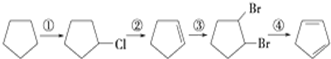
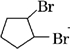 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr.
+2NaBr.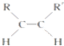 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式:
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式: $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$ .
. ).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):
).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):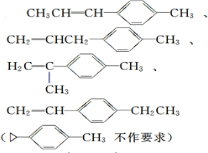 .
.