题目内容
4.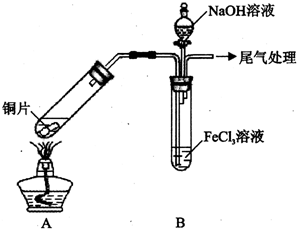 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).(1)实验前,应先检查装置的气密性;实验中产生的尾气应通人NaOH溶液.
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶.
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色.
【查阅资料】Fe( HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO${\;}_{4}^{2-}$.Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:
| 步骤② | 往5mL 1mol•LFeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热在较短时间内溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.短时间内发现溶液颜色变成浅绿色. |
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
分析 (1)制取气体的反应装置,制取之前应检查装置的气密性;二氧化硫尾气用NaOH溶液吸收;
(2)据配制一定物质的量浓度的溶液需要的仪器分析;
(3)FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,为FeCl2溶液,溶液显酸性;
(4)Fe(HSO3)2+离子可以将Fe3+还原为Fe2+,根据氧化还原反应特征书写离子方程式;
(5)铁氰化钾溶液与二价铁离子反应生成蓝色的Fe3(Fe(CN)6)2;
(6)综合上述实验分析,升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
解答 解:(1)制取气体的反应装置,制取之前应检查装置的气密性;二氧化硫尾气用NaOH溶液吸收,故答案为:气密性;NaOH;
(2)配制100mL1mol/L FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶,故答案为:胶头滴管、100mL的容量瓶;
(3)溶液显酸性,滴入NaOH溶液时,开始无现象,然后产生白色沉淀,故答案为:开始无现象,然后产生白色沉淀;
(4)Fe(HSO3)2+离子可以将Fe3+还原为Fe2+,则由氧化还原反应有升必有降,则离子方程式为:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+;
故答案为:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+;
(5)铁氰化钾溶液与二价铁离子反应生成蓝色的Fe3(Fe(CN)6)2,所以所加试剂为铁氰化钾溶液K3[Fe(CN)6],故答案为:K3[Fe(CN)6];
(6)综合上述实验分析,升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间,故答案为:加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
点评 本题考查的探究SO2与FeCl3溶液的反应过程的实验方案设计,为高频考点,把握发生的氧化还原反应及现象的关系为解答的关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. |  | B. |  | C. |  | D. | HO-CH2-CH2OH |
| A. | 0.2mol/(L•S) | B. | 0.1mol/(L•S) | C. | 0.04mol/(L•S) | D. | 0.08mol/(L•S) |
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
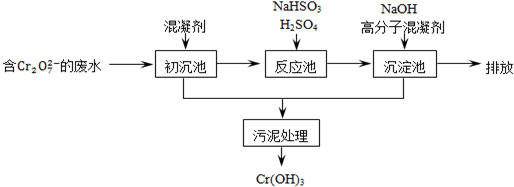
(1)Cr在周期表中的位置为第四周期第ⅥB族.
(2)初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
Al3++3H2O?Al(OH)3+3H+.
(3)请补充并配平以下反应池中发生主要反应的离子方程式:
1Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(4)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和Cr3++3OH-=Cr(OH)3↓.证明Cr3+沉淀完全的方法是取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全.
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.037 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)①和⑧能形成原子个数比1:1和2:1的化合物,原子个数比为1:1的化合物中存在的化学键:离子键和非极性共价键.
(2)写出由2个⑦的原子和4个③的原子构成的物质的电子式:

(3)写出④的最高价氧化物对应水化物与①的最高价氧化物对应水化物的水溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)下列叙述正确的是ABCD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑧在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
(5)①、⑥、⑧可以形成多种盐,其中一种盐中①、⑥、⑧三种元素的原子个数比为1:1:1,该盐的名称为次氯酸钠.它的水溶液与⑥的氢化物的水溶液反应可生成⑥的单质,该反应的离子方程式为ClO-+2H++Cl-═Cl2↑+H2O.
 用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
