题目内容
18.下列反应中,反应后固体物质增重的是( )| A. | 氢气通过灼热的CuO粉末 | B. | 碳与SiO2高温反应制粗硅 | ||
| C. | 将锌粒投入Cu(NO3)2溶液 | D. | 镁条在CO2中燃烧 |
分析 A.氢气还原CuO生成Cu和水;
B.C与二氧化硅反应生成Si和CO;
C.Zn与硝酸铜反应生成硝酸锌和Cu;
D.Mg与二氧化碳反应生成MgO和C.
解答 解:A.氢气还原CuO生成Cu和水,则反应前后固体质量减少为氧元素的质量,故A不选;
B.C与二氧化硅反应生成Si和CO,则反应前后固体质量减少为氧元素的质量,故B不选;
C.Zn与硝酸铜反应生成硝酸锌和Cu,则反应前后固体质量减少为等物质的量Zn、Cu的质量差,故C不选;
D.Mg与二氧化碳反应生成MgO和C,则反应前后固体增加的质量为二氧化碳的质量,故D选;
故选D.
点评 本题考查金属及化合物的性质,为高频考点,把握发生的反应及反应前后固体的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
9.欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.三种金属离子生成沉淀的pH如右表.
某含铬废水处理的主要流程如图所示:
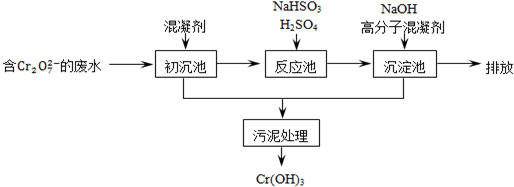
(1)Cr在周期表中的位置为第四周期第ⅥB族.
(2)初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
Al3++3H2O?Al(OH)3+3H+.
(3)请补充并配平以下反应池中发生主要反应的离子方程式:
1Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(4)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和Cr3++3OH-=Cr(OH)3↓.证明Cr3+沉淀完全的方法是取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全.
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |

(1)Cr在周期表中的位置为第四周期第ⅥB族.
(2)初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
Al3++3H2O?Al(OH)3+3H+.
(3)请补充并配平以下反应池中发生主要反应的离子方程式:
1Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(4)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和Cr3++3OH-=Cr(OH)3↓.证明Cr3+沉淀完全的方法是取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全.
13.如表是部分短周期元素的原子半径及主要化合价.
回答下列问题:
(1)①和⑧能形成原子个数比1:1和2:1的化合物,原子个数比为1:1的化合物中存在的化学键:离子键和非极性共价键.
(2)写出由2个⑦的原子和4个③的原子构成的物质的电子式: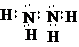
(3)写出④的最高价氧化物对应水化物与①的最高价氧化物对应水化物的水溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)下列叙述正确的是ABCD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑧在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
(5)①、⑥、⑧可以形成多种盐,其中一种盐中①、⑥、⑧三种元素的原子个数比为1:1:1,该盐的名称为次氯酸钠.它的水溶液与⑥的氢化物的水溶液反应可生成⑥的单质,该反应的离子方程式为ClO-+2H++Cl-═Cl2↑+H2O.
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.037 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)①和⑧能形成原子个数比1:1和2:1的化合物,原子个数比为1:1的化合物中存在的化学键:离子键和非极性共价键.
(2)写出由2个⑦的原子和4个③的原子构成的物质的电子式:
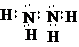
(3)写出④的最高价氧化物对应水化物与①的最高价氧化物对应水化物的水溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)下列叙述正确的是ABCD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑧在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
(5)①、⑥、⑧可以形成多种盐,其中一种盐中①、⑥、⑧三种元素的原子个数比为1:1:1,该盐的名称为次氯酸钠.它的水溶液与⑥的氢化物的水溶液反应可生成⑥的单质,该反应的离子方程式为ClO-+2H++Cl-═Cl2↑+H2O.
10.下列性质可以证明某化合物内一定存在离子键的是( )
| A. | 可溶于水 | B. | 水溶液能导电 | C. | 熔融状态可导电 | D. | 熔点350℃ |
8.下列过程属于氧化反应的是( )
| A. | 乙醇?乙醚 | B. | 乙醛?乙酸 | C. | 乙醛?乙醇 | D. | 乙酸?乙酸乙酯 |
 ;
;
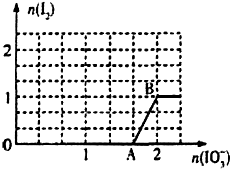 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.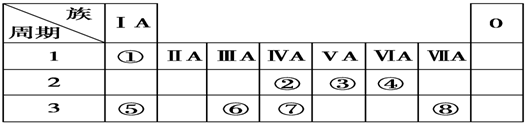
 .②的最高价氧化物的电子式是:
.②的最高价氧化物的电子式是: