题目内容
10.氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2•2H2O),已知氯化铜易溶于水,难溶于乙醇.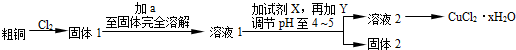
(1)溶液1中的金属离子有Fe3+、Fe2+、Cu2+.能检验溶液1中Fe2+的试剂②(填编号)
①KMnO4 ②K3[Fe(CN)6]③NaOH ④KSCN
为了更完全的沉淀,试剂X为H2O2.
(2)试剂Y用于调节pH以除去杂质,Y可选用下列试剂中的(填序号)cd.
a.NaOH b.NH3•H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
调节pH至4~5的原因是使溶液中Fe3+转化为Fe(OH)3沉淀,Cu2+离子不沉淀.
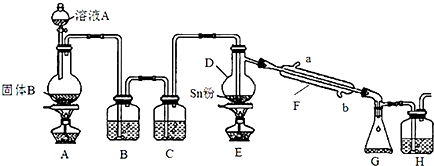
(3)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(部分加热和夹持装置已略去).
有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)否.理由是HCl不参与反应,且能抑制Cu2+水解.
(4)实验所需480mL10mol/L浓HCl配制时用到的玻璃仪器有量筒、玻璃棒、烧杯、胶头滴管、500mL容量瓶.
(5)该装置存在缺陷,请写出:缺少防止倒吸装置安全瓶.
(6)得到CuCl2•xH2O晶体最好采用的干燥方式是D.
A.空气中加热蒸干
B.空气中低温蒸干
C.HCl气流中加热烘干
D.HCl气流中低温烘干
(7)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x的值,某兴趣小组设计了以下实验方案:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng.沉淀洗涤的操作方法是向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次,根据实验数据测得x=$\frac{80m-135n}{18n}$(用含m、n的代数式表示).
分析 粗铜中含有Fe,与氯气反应生成CuCl2和FeCl3,为防止水解,应加入过量的稀盐酸进行溶解,并保证金属完全反应,溶液1中的金属离子有Fe3+、Fe2+、Cu2+,加入试剂X目的是将溶液中Fe2+氧化为Fe3+,应为H2O2,还原得到水,是绿色氧化剂,通过调节pH,使溶液中Fe3+转化为Fe(OH)3沉淀,过滤分离,且加入Y可以消耗氢离子且不能引入新杂质,可以为CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3.滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥得到CuCl2•2H2O,
(1)Fe2+具有还原性,可以使酸性高锰酸钾溶液褪色;能与K3[Fe(CN)6]反应得到蓝色铁氰化亚铁蓝色沉淀;加入试剂X目的是将溶液中Fe2+氧化为Fe3+,最好应为H2O2;
(2)调节pH至4~5之间,液中Fe3+转化为Fe(OH)3沉淀,Cu2+离子不沉淀,过滤分离;
(3)由于HCl不影响氯气和粗铜的反应的产物,且可以抑制氯化铜水解,氯气中混有的HCl不需要除去;
(4)实验所需480mL10mol/L浓HCl配制时用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管、500mL容量瓶;
(5)该装置缺少防止倒吸装置,在D、E之间添加防倒吸的安全瓶;
(6)CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干;
(7)氯化铜溶液中加入足量氢氧化钠溶液、过滤得到沉淀为氢氧化铜,沉淀洗涤的操作方法是:向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次;
氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒计算CuCl2•xH2O的物质的量,再结合m=nM计算x的值.
解答 解:粗铜中含有Fe,与氯气反应生成CuCl2和FeCl3,为防止水解,应加入过量的稀盐酸进行溶解,并保证金属完全反应,溶液1中的金属离子有Fe3+、Fe2+、Cu2+,加入试剂X目的是将溶液中Fe2+氧化为Fe3+,应为H2O2,还原得到水,是绿色氧化剂,通过调节pH,使溶液中Fe3+转化为Fe(OH)3沉淀,过滤分离,且加入Y可以消耗氢离子且不能引入新杂质,可以为CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3.滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥得到CuCl2•2H2O.
(1)①Fe2+具有还原性,可以使酸性高锰酸钾溶液褪色,但溶液中有氯离子,所以不能用高锰酸钾溶液检验Fe2+,故错误;
②Fe2+能与K3[Fe(CN)6]反应得到蓝色铁氰化亚铁蓝色沉淀,故正确;
③铁离子、铜离子均与NaOH反应生成沉淀,影响亚铁离子检验,故错误;
④铁离子与KSCN反应,溶液呈红色,不能检验Fe2+,故错误;
加入试剂X目的是将溶液中Fe2+氧化为Fe3+,X应为H2O2,还原得到水,是绿色氧化剂,
故答案为:②;H2O2;
(2)由上述分析可知,试剂X为盐酸,加入过量的盐酸,充分反应,抑制Cu2+水解;
加入Y可以消耗氢离子调节溶液pH,使溶液中Fe3+转化为Fe(OH)3沉淀,过滤分离,且不能引入新杂质,
a.NaOH引入杂质钠离子,故a错误;
b.NH3•H2O 引入铵根离子,故b错误;
c.CuO可以调节PH值,除去杂质,过量的CuO过滤除去,不引入杂质,故c正确;
d.Cu2(OH)2CO3 可以调节PH值,除去杂质,过量的Cu2(OH)2CO3 过滤除去,不引入杂质,故d正确;
e.CuSO4不能调节PH值,引入硫酸根离子,故e错误;
调节pH至4~5之间,使溶液中Fe3+转化为Fe(OH)3沉淀,Cu2+离子不沉淀,
故答案为:cd;使溶液中Fe3+转化为Fe(OH)3沉淀,Cu2+离子不沉淀;
(3)HCl对反应没有影响,且可以抑制氯化铜水解,不需要在浓硫酸洗气瓶前增加吸收HCl的装置,
故答案为:否;HCl不参与反应,且能抑制Cu2+水解;
(4)实验所需480mL10mol/L浓HCl配制时用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管、500mL容量瓶,
故答案为:胶头滴管、500mL容量瓶;
(5)该装置缺少防止倒吸装置,在D、E之间添加防倒吸的安全瓶,
故答案为:缺少防止倒吸装置安全瓶;
(6)CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干,
故答案为:D;
(7)氯化铜溶液中加入足量氢氧化钠溶液、过滤得到沉淀为氢氧化铜,沉淀洗涤的操作方法是:向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次;
氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒:n(CuCl2•xH2O)=n(CuO)=$\frac{n}{80}$mol,则$\frac{n}{80}$mol×(135+18x)=mg,解得x=$\frac{80m-135n}{18n}$,
故答案为:向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次;$\frac{80m-135n}{18n}$.
点评 本题考查化学工艺流程及实验制备,涉及对实验装置与操作及试剂的分析评价、物质分离提纯、化学平衡移动、化学计算等,要求学生具备扎实的基础与综合运用能力,难度很大.

| A. | 锅炉中沉积的水垢大部份可以用稀盐酸溶解去除 | |
| B. | 加热FeCl3饱和溶液制备Fe(OH)3促进了Fe3+水解 | |
| C. | 向纯水中加入盐酸或降温都能使水的离子积减小,水的电离平衡都逆向移动 | |
| D. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H<0 |
| A. | 高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32- )=1 mol•L-1,则溶液中Na+的个数为2 NA | |
| D. | 含4 NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中c(Na+)=2 mol•L-1 |
| 元素符号:Cs 中文名称:铯 英文名称:Cesium 原子序数:55 相对原子质量:132.9 核外电子排布:2,8,18,18,8,1 |
| A. | 两者互为同位素 | |
| B. | 两者原子核内中子数相差3 | |
| C. | 两者氯化物的化学式都可以表示为CsCl2 | |
| D. | Cs元素位于周期表第六周期 |
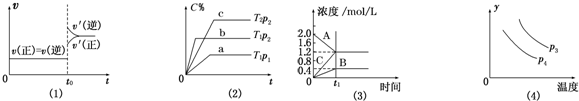
| A. | 图(1)是N2(g)+3H2(g)?2NH3(g)的化学平衡图象,在t0时刻充入一定量的NH3,平衡逆向移动 | |
| B. | 图(3)表示的化学方程式为2A═B+3C | |
| C. | 图(2)中p2>p1,T1>T2 | |
| D. | 图(4)对应反应2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |