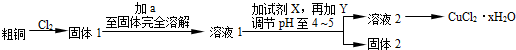题目内容
1.已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)?CO2(g)+H2(g),在密闭容器中,将1.0mol CO与3.6mol H2O混合加热到434℃,在434℃的平衡常数K1=9,(1)我们跟踪测定H2O的物质的量浓度,如图所示:则0~20min的反应速率是0.00045mol/(L.min)
(2)从434℃升温至800℃,800℃的平衡常数K2=1,则正反应为放热反应(填“放热反应”或“吸热反应”或“不能确定”).
(3)求800℃平衡时CO转化为CO2的转化率(写出必要的计算过程).
分析 (1)根据v=$\frac{△c}{△t}$计算;
(2)升高温度,平衡常数减小,说明升高温度平衡逆向移动,正反应为放热反应;
(3)设800℃平衡时转化的CO为xmol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 3.6 0 0
变化量(mol):x x x x
平衡量(mol):1-x 3.6-x x x
由于反应前后气体体积不变,可以利用物质的量代替浓度计算平衡常数,根据平衡常数列方程计算解答.
解答 解:(1)由图可知,0~20min内水的浓度变化量为(0.036-0.027)mol/L=0.009mol/L,则0~20min的反应速率是$\frac{0.009mol/L}{20s}$=0.00045mol/(L.min),故答案为:0.00045mol/(L.min);
(2)升高温度,平衡常数减小,说明升高温度平衡逆向移动,升高温度向吸热反应移动,则正反应为放热反应,故答案为:放热反应;
(3)设800℃平衡时转化的CO为xmol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 3.6 0 0
变化量(mol):x x x x
平衡量(mol):1-x 3.6-x x x
由于反应前后气体体积不变,可以利用物质的量代替浓度计算平衡常数,则$\frac{x×x}{(1-x)×(3.6-x)}$=1,解得x=$\frac{18}{23}$,故CO的转化率为$\frac{\frac{18}{23}mol}{1mol}$×100%=78.26%,
答:CO的转化率为78.26%.
点评 本题考查化学平衡计算、反应速率计算,注意平衡常数在化学平衡中的应用,难度不大.

| A. | 加盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO$\stackrel{2-}{3}$存在 | |
| B. | 用某溶液做焰色反应实验火焰为黄色,则该溶液中一定有钠元素,可能有钾元素 | |
| C. | 加硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在 | |
| D. | 分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐酸盐溶液,只用NaOH溶液是不能一次鉴别开的 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 一定含有SO42- | B. | 一定同时含有Ag+和SO42- | ||
| C. | 一定含有Ag+ | D. | Ag+或SO42-至少含有一种 |
| A. | IBr的化学性质不如氯气活泼 | |
| B. | 在很多反应中IBr充当氧化剂 | |
| C. | IBr跟水反应时既是氧化剂又是还原剂 | |
| D. | 跟NaOH溶液反应生成NaBr和NaIO |
| A. | Na2SeO3在反应中做还原剂 | B. | Na2SeO3在反应中做氧化剂 | ||
| C. | 亚硒酸钠中硒的化合价为+6价 | D. | “活性氧”在反应中做催化剂 |
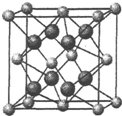 氟在自然界中常以CaF2的形式存在.
氟在自然界中常以CaF2的形式存在.