题目内容
20.下列叙述与图象相对应的是( )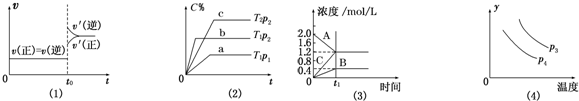
| A. | 图(1)是N2(g)+3H2(g)?2NH3(g)的化学平衡图象,在t0时刻充入一定量的NH3,平衡逆向移动 | |
| B. | 图(3)表示的化学方程式为2A═B+3C | |
| C. | 图(2)中p2>p1,T1>T2 | |
| D. | 图(4)对应反应2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |
分析 A、在t0时刻充入一定量的NH3,是增大生成物的浓度,此时逆反应速率突然增大,正反应速率此时不变;
B、图3中A减小为反应物,BC浓度增大为生成物,A消耗2.0mol/L-1.2mol/L=0.8mol/L,B生成0.4mol/L,C生成1.2mol/L,反应之比等于化学方程式计量数之比;
C、先拐先平,温度、压强大;
D、温度升高平衡向吸热反应方向进行,反应是放热反应,升温平衡逆向进行.
解答 解:A、在t0时刻充入一定量的NH3,是增大生成物的浓度,此时逆反应速率突然增大,正反应速率此时不变,图象中应在原平衡点,故A错误;
B、图3中A减小为反应物,BC浓度增大为生成物,A消耗2.0mol/L-1.2mol/L=0.8mol/L,B生成0.4mol/L,C生成1.2mol/L,反应之比等于化学方程式计量数之比=0.8:0.4:1.2=2:1:3,反应是可逆反应,反应的化学方程式为:2A?B+3C,故B错误;
C、先拐先平,达到平衡的时间短,反应先达到平衡,温度、压强大,p2>p1,T1>T2,故C正确;
D、温度升高平衡向吸热反应方向进行,反应是放热反应,升温平衡逆向进行,Y的百分含量增大,故D错误;
故选C.
点评 本题考查了化学平衡影响因素的分析判断,主要是图象的理解和图线变化的分析应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
11.进入人体的O2有2%转化为“活性氧”,它能加速人的衰老,被称为“生命杀手”,服用亚硒酸钠(Na2SeO3)能消除人体内的“活性氧”.下列说法正确的是( )
| A. | Na2SeO3在反应中做还原剂 | B. | Na2SeO3在反应中做氧化剂 | ||
| C. | 亚硒酸钠中硒的化合价为+6价 | D. | “活性氧”在反应中做催化剂 |
8.下列物质属于无氧酸的是( )
| A. | H2SO4 | B. | HF | C. | H2CO3 | D. | H2SiO3 |
5.下列对于“摩尔”的理解正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔 |
12. (1)Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
(1)Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:Mn元素价电子层的电子排布式为3d54s2,比较两元素I.I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转化为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6转化为稳定的3d5半充满较稳定状态,需要的能量相对要少
(2)白色的无水硫酸铜粉末溶于水后得到蓝色溶液,请解释这一现象的原因(用离子方程式):Cu2++4H2O=[Cu(H2O)4]2+,向蓝色溶液中加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解得到深蓝色透明溶液,请写出沉淀溶解过程的离子方程式Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
(3)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.晶体结构如下图所示,其晶胞边长为540.0pm,晶胞中Zn原子的配位数为4,列式表示并计算立方ZnS晶体的密度(g•cm-3)4.1g/(cm)3.
 (1)Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
(1)Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元 素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(2)白色的无水硫酸铜粉末溶于水后得到蓝色溶液,请解释这一现象的原因(用离子方程式):Cu2++4H2O=[Cu(H2O)4]2+,向蓝色溶液中加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解得到深蓝色透明溶液,请写出沉淀溶解过程的离子方程式Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O.
(3)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.晶体结构如下图所示,其晶胞边长为540.0pm,晶胞中Zn原子的配位数为4,列式表示并计算立方ZnS晶体的密度(g•cm-3)4.1g/(cm)3.
9.下列说法全不正确的是( )
①.CH3-CH=CH2和CH2=CH2的最简式相同
②.CH≡CH和C6H6含碳量相同
③.戊烯和丁烯互为同系物
④.能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法.
①.CH3-CH=CH2和CH2=CH2的最简式相同
②.CH≡CH和C6H6含碳量相同
③.戊烯和丁烯互为同系物
④.能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ④ |
10.下列物质中,属于可再生的能源是( )
| A. | 氢气 | B. | 石油 | C. | 煤 | D. | 天然气 |