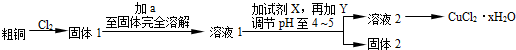题目内容
18.四氯化锡常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡.已知SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟.实验室可用如图装置合成四氯化锡(夹持装置略).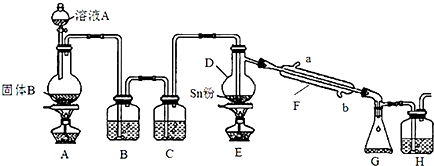
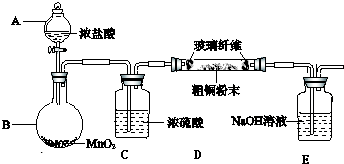
(1)装置D的名称为蒸馏烧瓶;
(2)冷凝水应从b(填“a”或“b”)口进入F中;
(3)装置A中固体B为黑色粉末,写出烧瓶中发生反应的化学反应方程式为MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)假设没有装置C,在D中除生成SnCl4外,可能得到的副产物为SnO2(其它合理答案如Sn(OH)4、H2SnO3、H4SnO4也可);
(5)装置E中加热的目的是促进氯气与锡粉反应、促进SnCl4气化,使SnCl4从反应混合物中分离出去;
(6)装置H中盛放足量的FeBr2溶液可吸收尾气中的氯气,其反应的离子反应方程式为2Fe2++Cl2═2Fe3++2Cl-.
(7)该实验装置存在设计缺陷,你的改进措施为在装置G、H之间连接盛有碱石灰的干燥管(或U形管).
(8)若装置A中标准状况下生成6.72L气体,假设不计气体损耗且Sn足量,反应完毕后在G 中锥形瓶里收集到37.20g SnCl4,则SnCl4的产率为95.0%.(已知SnCl4相对分子质量为261)
分析 题中所制SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟,故利用氯气制SnCl4时,应保持干燥无氧环境,同时还要考虑Cl2本身的除杂,装置E加热的目的是使生成的SnCl4气化,使SnCl4从反应混合物中分离出去,并经过冷凝管液化后进行收集要,最后再碱性溶液吸收含有氯气的尾气,反应产率可根据A中生成的氯气计算出理论产值,再求算产率;
(1)结合常见的仪器可判断D装置的仪器名称;
(2)冷凝管里冷却水的方向应该与气流方向相反;
(3)装置A是实验室制氯气,反应物为二氧化锰和浓盐酸,生成氯化锰及氯气;
(4)没有装置C,进入D装置的氯气中混有水汽,SnCl4遇水会水解,产生杂质;
(5)装置E是制SnCl4的反应装置,加热会加快反应时行,同时因SnCl4沸点较低,可使SnCl4气化便于分离与收集;
(6)装置H中盛放足量的FeBr2溶液,利用氯气可氧化FeBr2,达到吸收尾气中氯气的目的;
(7)因SnCl4易水解,在尾气处理装置前要增加一个干燥装置,防止有水蒸汽进入G中;
(8)根据反应A中生成的氯气可计算SnCl4理论产量,再结合实际产量,计算产率.
解答 解:(1)根据装置D的结构特点和应用可知为蒸馏烧瓶,故答案为:蒸馏烧瓶;
(2)为了冷却充分,使冷凝水充满整个冷凝管,冷凝水应该从b口进,a口出,故答案为:b;
(3)装置A中是在加热条件下浓盐酸与二氧化锰反应制备Cl2,其化学反应方程式为:MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O,帮答案为:MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O;
(4)装置A制备的Cl2中含有HCl和水蒸气,装置B中盛有饱和食盐水,可除去Cl2中的HCl,装置C中应该盛放浓H2SO4,除去Cl2中的水蒸气,若没有装置C,水蒸气会进入装置D中,根据题目信息,生成的SiCl4能与H2O发生反应:SnCl4+4H2O$\stackrel{△}{?}$Sn(OH)4+4HCl,加热促进其水解,生成的Sn(OH)4分解生成SnO2,所以可能得到的副产物为SnO2,故答案为:SnO2(其它合理答案如Sn(OH)4、H2SnO3、H4SnO4也可);
(5)Sn与Cl2反应需在加热条件下进行,同时生成的SnCl4的沸点为114℃,加热促进SnCl4气化,进入37装置F中,然后冷却分离,故答案为:促进氯气与锡粉反应、促进SnCl4气化,使SnCl4从反应混合物中分离出去;
(6)氯气能氧化FeBr2生成氯化铁和溴,发生反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(7)装置H中的水蒸气会进入装置G中导致SnCl4水解,所以应该在装置G、H之间连接一个盛有碱石灰的干燥管(或U形管),防止空气中的水蒸气进入装置G中,故答案为:在装置G、H之间连接盛有碱石灰的干燥管(或U形管);
(8)根据反应:Sn+2Cl2$\frac{\underline{\;加热\;}}{\;}$SnCl4,6.72L标准状况下的Cl2体积为0.3mol,理论上可得0.15molSnCl4,其质量=0.15mol×261g/mol=39.15g,故SnCl4的产率=$\frac{37.20g}{39.15g}×100%$=95.0%,故答案为:95.0%.
点评 本题具有基础性、灵活性和拓展性特点,与近年高考命题具有相似性,通过本题的分析和解答,体验如何应用信息设计相应实验的基本套路,提升同学们的应试能力.解答本题的关键:一、明确实验目的是制备纯净SnCl4,结合SnCl4(易水解)从而得出装置存在的缺陷、副产物的产生等.二、计算SnCl4的产率时要结合反应方程式找出理论值,然后用实际得到的SnCl4质量与理论值相比即可.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | IBr的化学性质不如氯气活泼 | |
| B. | 在很多反应中IBr充当氧化剂 | |
| C. | IBr跟水反应时既是氧化剂又是还原剂 | |
| D. | 跟NaOH溶液反应生成NaBr和NaIO |
| A. | 含1mol H2SO4的浓硫酸与足量铜反应转移的电子总数为2NA | |
| B. | 标准状况下,22.4LO2作氧化剂时转移电子数一定为4NA | |
| C. | 10L0.1mol•L-1的Na2CO3溶液中,Na+、CO32-总数为3NA | |
| D. | 通常状况下,4.2g丙烯中所含碳氢键数目为0.6NA |
| A. | H2SO4 | B. | HF | C. | H2CO3 | D. | H2SiO3 |
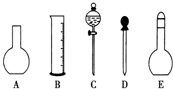 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: