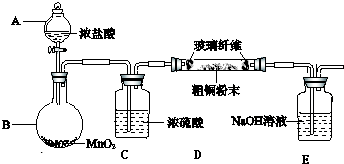
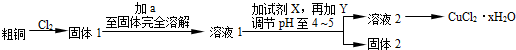题目内容
11.下列叙述中不正确的是( )| A. | 锅炉中沉积的水垢大部份可以用稀盐酸溶解去除 | |
| B. | 加热FeCl3饱和溶液制备Fe(OH)3促进了Fe3+水解 | |
| C. | 向纯水中加入盐酸或降温都能使水的离子积减小,水的电离平衡都逆向移动 | |
| D. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H<0 |
分析 A.锅炉中沉积的水垢主要含有碳酸钙和氢氧化镁;
B.加热促进盐的水解;
C.水的离子积只受温度影响;
D.化学反应中△G=△H-T△S<0时,该反应能自发进行.
解答 解:A.锅炉中沉积的水垢主要含有碳酸钙和氢氧化镁,碳酸钙和氢氧化镁能溶于盐酸,所以可以用稀盐酸溶解去除,故A正确;
B.盐的水解反应是吸热反应,加热促进盐的水解,则加热FeCl3饱和溶液制备Fe(OH)3促进了Fe3+水解,故B正确;
C.水的离子积只受温度影响,向纯水中加入盐酸水的离子积不变,故C错误;
D.化学反应中△G=△H-T△S<0时,该反应能自发进行,应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应△G=△H-T△S<0,该反应的△S<0,则△H<0,故D正确;
故选C.
点评 本题考查水的电离、难溶物溶解平衡、反应焓变和熵变、盐的水解原理等知识点,侧重考查化学反应原理,题目难度中等.

练习册系列答案
相关题目
2.检验有关溶液中所含的离子,下列判断中正确的是( )
| A. | 加盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO$\stackrel{2-}{3}$存在 | |
| B. | 用某溶液做焰色反应实验火焰为黄色,则该溶液中一定有钠元素,可能有钾元素 | |
| C. | 加硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在 | |
| D. | 分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐酸盐溶液,只用NaOH溶液是不能一次鉴别开的 |
6.下列操作属于萃取的是( )
| A. | 向溴的煤油溶液里加入苯后振荡 | B. | 向溴水中加入四氯化碳后振荡 | ||
| C. | 向硫的二硫化碳溶液里加水后振荡 | D. | 向碘水里加入酒精后振荡 |
16.下列实验现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到胆矾晶体上 | 晶体逐渐变成白色 | 该过程发生物理变化 |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成蓝色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 向硝酸亚铁溶液中滴入稀硫酸 | 无明显现象 | 硝酸亚铁与硫酸不反应 |
| D | 将滴有酚酞的氨水加热 | 红色逐渐变浅 | 一水合氨受热分解,导致溶液碱性减弱 |
| A. | A | B. | B | C. | C | D. | D |
20.下列原子的轨道表示式正确的是( )
| A. |  | B. |  | C. |  | D. |  |
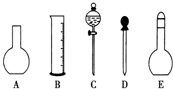 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: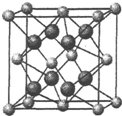 氟在自然界中常以CaF2的形式存在.
氟在自然界中常以CaF2的形式存在.