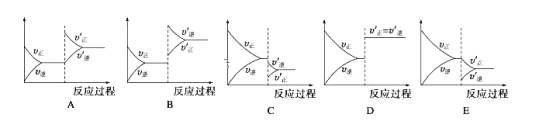
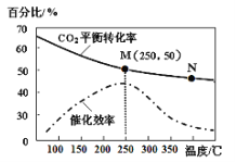
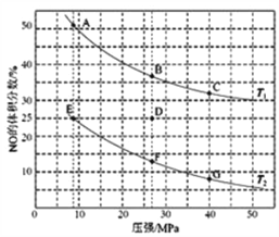
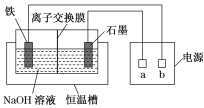
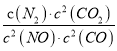题目内容
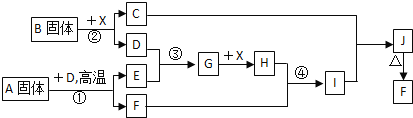
【题目】根据下列框图关系填空,已知反应![]() 、
、![]() 是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为
是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为![]() .
.
(1)![]() 的化学式为______;
的化学式为______;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为______;
(3)反应![]() 的离子方程式:______;
的离子方程式:______;
(4)反应![]() 的离子方程式:______;
的离子方程式:______;
(5)已知每生成![]() ,放出
,放出![]() 热量,则反应
热量,则反应![]() 的热化学方程式为:______.
的热化学方程式为:______.
【答案】![]()
![]()
![]()
![]()
![]() ;
;![]()
【解析】
X常温下为无色无味透明液体,X为水;C焰色反应火焰呈黄色,说明C中含钠元素,J为红褐色沉淀,J为氢氧化铁,则F为Fe2O3;D、E常温下为气体,且E能使品红溶液褪色说明E为SO2;G为SO3;H为H2SO4;I为硫酸铁;根据①,③两个反应是我国工业生产中的重要反应,且均有D参与,则D为氧气(氧化反应),所以B为过氧化钠,C为氢氧化钠;A和D在高温下反应生成二氧化硫和氧化铁,是工业生产硫酸的重要反应;A固体中仅含Fe、S两种元素,其中铁的质量分数约为![]() ,所以A为FeS2,依据判断出的物质进行分析解答。
,所以A为FeS2,依据判断出的物质进行分析解答。
(1)依据上述分析,G为SO3故答案为:SO3
(2)固体A中所包含的化学键与固体B类似,是过硫化亚铁,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)反应②是过氧化钠与水反应,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)反应④是三氧化二铁和硫酸反应,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(5)已知每生成16g E为SO2,物质的量为0.25mol,放出106.5kJ热量,依据化学方程式4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g);生成8molSO2,放热为:![]() =3408kJ,反应①是二硫化亚铁和氧气反应生成三氧化二铁和二氧化硫,反应的热化学方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol,故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=-3408 kJ/mol。
=3408kJ,反应①是二硫化亚铁和氧气反应生成三氧化二铁和二氧化硫,反应的热化学方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol,故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=-3408 kJ/mol。

 优学名师名题系列答案
优学名师名题系列答案