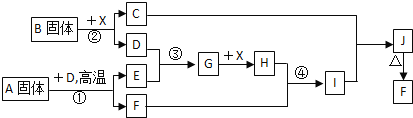
题目内容
【题目】美国计划2020年再次登陆月球,并在月球上建立永久性基地,为人类登陆新的行星做好前期准备。为了解决基地人员的供氧问题,科学家设想利用月球富氧岩石制取氧气。其提氧原理是用氢气还原富氧岩石获取水,再利用太阳能电池电解水得到氢气和氧气。
玄武岩(含钛铁矿)是月球的主要岩石之一,其质地坚硬,钛铁矿的主要成分为钛酸亚铁(![]() )。用上述提氧原理,理论上,从1 kg
)。用上述提氧原理,理论上,从1 kg ![]() 中可获取105.3g
中可获取105.3g ![]() 。
。
(1)写出![]() 与
与![]() 反应的化学方程式:______________________________________________。
反应的化学方程式:______________________________________________。
(2)研究表明,月球上平均直径为40微米的小圆珠形成的堆积物(富含![]() )是最适合提氧的矿物。这种堆积物作为提氧原料的优点是____________________________________________________________。
)是最适合提氧的矿物。这种堆积物作为提氧原料的优点是____________________________________________________________。
(3)研究人员查阅文献后,得知钛铁矿在高温下还能被炭粉还原: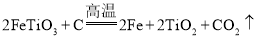 ,
,![]() 通过植物的光合作用可获得
通过植物的光合作用可获得![]() ,化光学方程式为
,化光学方程式为![]() (葡萄糖)
(葡萄糖)![]() 。他们设计了两套实验装置来测定钛铁矿中可提取氧的质量分数。
。他们设计了两套实验装置来测定钛铁矿中可提取氧的质量分数。
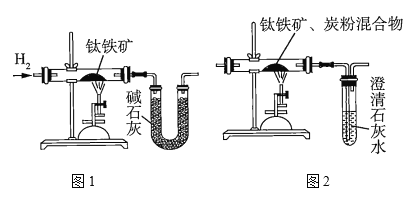
研究人员用图1装置从钛铁矿中提取氧,实验中得出的可提取氧的质量分数大于理论值,产生这种情况的原因可能是______________________;用图2装置进行实验的过程中,称得反应前钛铁矿的质量为![]() ,炭粉的质量为
,炭粉的质量为![]() ,钛铁矿完全反应后,测得生成
,钛铁矿完全反应后,测得生成![]() 的质量为
的质量为![]() ,则钛铁矿中可提取氧的质量分数为________________。
,则钛铁矿中可提取氧的质量分数为________________。
(4)在钛铁矿提氧过程中科学家们常选用![]() 而不用其他还原剂,其主要原因是______________________。
而不用其他还原剂,其主要原因是______________________。
【答案】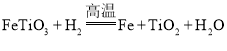 无需进行岩石破碎工作、可提取氧的质量分数大
无需进行岩石破碎工作、可提取氧的质量分数大 ![]() 未经干燥、U形管中碱石灰吸收了空气中的水分
未经干燥、U形管中碱石灰吸收了空气中的水分 ![]()
![]() 的氧化产物水无污染,电解水产生的
的氧化产物水无污染,电解水产生的![]() 能够循环利用
能够循环利用
【解析】
钛铁矿的主要成分为钛酸亚铁(![]() )与氢气发生氧化还原反应得到水,再电解水得到氧气,根据得失电子守恒,推知
)与氢气发生氧化还原反应得到水,再电解水得到氧气,根据得失电子守恒,推知![]() 中铁元素化合价降低;
中铁元素化合价降低;
(1)![]() 的物质的量为6.58 mol,105.3g
的物质的量为6.58 mol,105.3g ![]() 中含O的物质的量为6.58 mol,故结合提氧原理可知
中含O的物质的量为6.58 mol,故结合提氧原理可知![]() 生成
生成![]() 的物质的量也为6.58 mol,
的物质的量也为6.58 mol,![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]() ,据此可确定反应的化学方程式。
,据此可确定反应的化学方程式。
(2)无需进行岩石破碎工作、可提取氧的质量分数大,故平均直径为40微米的小圆珠形成的堆积物(富含![]() )是最适合提氧的矿物。
)是最适合提氧的矿物。
(3)图1中测得的可提取氧的质量分数大于理论值,则可能是通入的![]() 未经干燥、U形管中的碱石灰吸收了空气中的水蒸气;因为图2中生成
未经干燥、U形管中的碱石灰吸收了空气中的水蒸气;因为图2中生成![]() 的质量为
的质量为![]() ,故
,故![]() 经光合作用可获得的
经光合作用可获得的![]() 的质量为
的质量为![]() ,所以钛铁矿中可提取氧的质量分数为
,所以钛铁矿中可提取氧的质量分数为![]() 。
。
(4)![]() 作还原剂的优点为:
作还原剂的优点为:![]() 的氧化产物水无污染,电解水产生的
的氧化产物水无污染,电解水产生的![]() 能够循环利用。
能够循环利用。

【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液b.CH3COONa 溶液c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”);
(3)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________。