题目内容
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 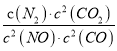 ,请写出此反应的热化学方程式___________________。
,请写出此反应的热化学方程式___________________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为_______。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
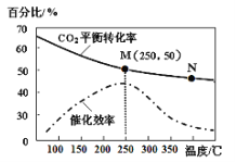
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
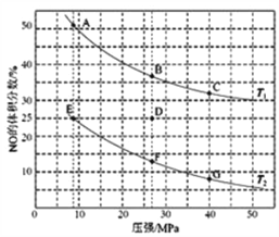
回答下列问题:
①温度:T1______ T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=______(保留两位有效数字);用CO的浓度变化表示的平均反应速率V(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的_______点。
【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=-746.5kJ/mol 2NO2 + 8e- =N2 + 4O2— ①③④ > 0.22或2.2×10-1 0.1 mol/(Lmin) A
【解析】试题分析:根据盖斯定律,写热化学方程式。
(2)电池的正极得电子发生还原反应。
(3) ①根据图示,M点催化剂催化效果最好;
②随温度升高,二氧化碳的平衡转化率减小;
③温度低于250℃时,随温度升高乙烯转化率减小;
④实际反应应从反应限度和反应速率两方面选择反应条件。
(2) ①2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol,升高温度平衡逆向移动,NO体积分数增大。
②利用“三段式”计算平衡常数;根据![]() 计算平均反应速率。
计算平均反应速率。
③若在D处对反应容器升温的同时扩大体积至体系压强减小,平衡逆向移动,NO体积分数增大。
解析:试题分析:若某反应的平衡常数表达式为: 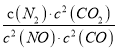 ,则方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g),根据盖斯定律,△ H=-746.5kJ/mol,热化学方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol。
,则方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g),根据盖斯定律,△ H=-746.5kJ/mol,热化学方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol。
(2) 电池的正极得电子发生还原反应,则正极反应式为2NO2 + 8e- =N2 + 4O2- 。
(3)①M点催化剂催化效果最好,所以M点的速率最大,故①错误;
②随温度升高,二氧化碳的平衡转化率减小,M点时平衡常数比N点时平衡常数大,故②正确;③温度低于250℃时,随温度升高乙烯的产率减小,故③错误;
④实际反应应尽可能在250℃下进行,提高单位时间的产量,故④错误。
(2)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
回答下列问题:
①2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol,升高温度平衡逆向移动,NO体积分数增大,所以T1>T2。
②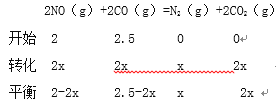
![]() ,x=0.5
,x=0.5
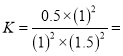 0.022 ;根据
0.022 ;根据![]() , 用CO的浓度变化表示的平均反应速率V(CO)=
, 用CO的浓度变化表示的平均反应速率V(CO)= ![]() 0.1 mol/(Lmin)。
0.1 mol/(Lmin)。
③若在D处对反应容器升温的同时扩大体积至体系压强减小,平衡逆向移动,NO体积分数增大,故选 A点。

 名校课堂系列答案
名校课堂系列答案