题目内容
【题目】短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,回答下列问题:
A | B | |
C | D |
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1 mol气态氢化物对应的热量变化如下,其中能表示该主族第四周期元素的单质生成1 mol气态氢化物所对应的热量变化是______![]() 选填字母编号
选填字母编号![]() 。
。
![]() 吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。
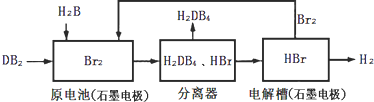
①查得:
化学键 | H-H | Br-Br | H-Br |
键能(kJ/mol) | 436 | 194 | 362 |
试写出通常条件下电解槽中发生总反应的热化学方程式:______。
②根据资料:
化学式 | Ag2SO4 | AgBr |
溶解度(g) | 0.796 | 8.4×10-6 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到______,证明分离效果较好。
③在原电池中,负极发生的反应式为______。
④在电解过程中,电解槽阴极附近溶液pH______(填“变大”、“变小”或“不变”)。
⑤将该工艺流程用总反应的化学方程式表示为:________,该生产工艺的优点有_____(答一点即可);缺点有____(答一点即可)。
(3)溴及化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入______,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为______。
(4)CuBr2分解的热化学方程式为:2CuBr2(s)![]() 2CuBr(s)+Br2(g)△H=+105.4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
2CuBr(s)+Br2(g)△H=+105.4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会______(填“增大”“不变”“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为______。
【答案】b 2HBr(aq)=Br2(aq)+H2(g) △H=+94kJ/mol 无淡黄色沉淀出现,最终出现白色沉淀 SO2+2H2O-2e-=SO42-+4H+ 变大 SO2+2H2O=H2+H2SO4 溴可以循环利用,获得清洁能源氢气 生成过程有有毒物质,电解循环能源消耗大 Cl2 Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3- 增大 2.33×103Pa<p(Br2)≤4.66×103Pa
【解析】
由短周期元素A、B、C、D在周期表中的位置可知,A、B处于第二周期,C、D处于第三周期,B、D最外层电子数之和为12,二者同主族,原子最外层电子数为6,则B为O元素,D为S元素,由元素的相对位置关系可知,A为N元素,C为Si元素,B、D两种元素可以形成SO2、SO3两种分子,且SO2具有漂白性。
(1)同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大;
(2)①根据电解槽中加入的物质和反应产生的物质判断总反应方程式;
②分离完全,硫酸中不含HBr,加入AgNO3溶液,根据沉淀颜色判断;
③在原电池中,负极发生氧化反应,SO2在负极放电生成H2SO4;
④在电解过程中,电解槽阴极发生还原反应,电极反应式为2H++2e-=H2↑,氢离子浓度降低;
⑤原电池总反应与电解池总反应相加可得该工艺流程用总反应的化学方程式SO2+2H2O=H2+H2SO4;该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,缺点是:生成过程有有毒物质,电解循环消耗能源大;
(3)海水提溴过程中,向浓缩的海水中通入氯气,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,同时生成HCO3-或CO2;
(4)①根据温度对化学平衡移动的影响分析;
②根据体积改变分析体系的压强变化,然后利用压强对平衡移动的影响分析解答。
根据上述分析可知A是N元素,B是O元素,C是Si元素,D是S元素,H2O是H2O,DB2是SO2,H2DB4为H2SO4。
(1)Se与O元素同族元素,属于第四周期,由于同一主族元素从上到下元素的非金属性逐渐减弱,单质与氢气反应剧烈程度减小,反应热增大,故生成1 mol硒化氢(H2Se)反应热应排在第二位,应为+29.7 kJ/mol,故合理选项是b;
(2)①根据装置图可知:电解的物质是HBr,反应生成的物质是Br2、H2,所以反应方程式为:2HBr![]() Br2+H2↑,由表中数据可知反应热△H=+362 kJ/mol×2-436 kJ/mol-194 kJ/mol=+94 kJ/mol,故热化学方程式为:2HBr(aq)=Br2(aq)+H2(g) △H=+94kJ/mol;
Br2+H2↑,由表中数据可知反应热△H=+362 kJ/mol×2-436 kJ/mol-194 kJ/mol=+94 kJ/mol,故热化学方程式为:2HBr(aq)=Br2(aq)+H2(g) △H=+94kJ/mol;
②分离后的H2SO4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若不能观察到淡黄色沉淀产生,最终生成白色沉淀,说明分离效果较好;
③在原电池中,负极发生氧化反应,SO2在负极放电生成H2SO4,电极反应式为SO2+2H2O-2e-=4H++SO42-;
④在电解过程中,电解槽阴极发生还原反应,电极反应式为2H++2e-=H2↑,氢离子浓度降低,导致溶液pH变大;
⑤原电池中电池总反应为SO2+Br2+2H2O=H2SO4+2HBr,电解池中总反应为2HBr=H2+Br2,故该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2SO4+H2。该生产工艺的优点:溴可以循环利用,获得清洁能源氢气;缺点是:生成过程有有毒物质,电解循环能源消耗大;
(3)海水提溴过程中,向浓缩的海水中通入氯气,将其中的Br-氧化为Br2,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴在碳酸钠碱性溶液中发生歧化反应可把理解为溴与水发生歧化,产生H+的被碳酸钠吸收,反应的离子方程式为3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3-;
(4)①升高温度,化学平衡向吸热的正反应方向移动,使气体的物质的量增大,因而可提高p(Br2),p(Br2)将会增大;
②若将容器的体积增大一倍时,p(Br2)降为原来的一半,即2.33×103Pa。减压使化学平衡向气体体积数增大的方向移动,即向正反应方向移动,因而最终达到平衡时会大于2.33×103Pa,但总的来说压强小于原压强4.66×103Pa;若反应物足量,可使平衡恢复到原有的p(Br2),故p(Br2)的取值范围2.33×103Pa< p(Br2)≤4.66×103Pa。

 名校课堂系列答案
名校课堂系列答案【题目】![]() 氯丙酸
氯丙酸![]() 主要用于生产农药除草剂,还用于生产乳酸及有工业价值的低级醇酯。如图为实验室制备
主要用于生产农药除草剂,还用于生产乳酸及有工业价值的低级醇酯。如图为实验室制备![]() 氯丙酸的装置。
氯丙酸的装置。
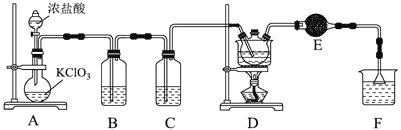
已知:相关物质的物理性质如下表所示:
物质 | 熔点 | 沸点 | 溶解性 |
| 14 | 190 | 能与水、乙醇互溶 |
丙酸 |
| 141 | 能与水、乙醇互溶 |
|
|
| 与水剧烈反应,能溶于乙醇 |
制备方法:在三颈烧瓶中放置![]() 丙酸和
丙酸和![]() 三氯化磷
三氯化磷![]() 作催化剂
作催化剂![]() ,加热至
,加热至![]() ,缓慢通入氯气,保持温度在
,缓慢通入氯气,保持温度在![]() 之间大约反应
之间大约反应![]() 。
。
回答下列问题:
![]() 装置中反应的离子方程式为_____________________________________________,当生成
装置中反应的离子方程式为_____________________________________________,当生成![]() (标准状况)时,转移电子的数目为________________。
(标准状况)时,转移电子的数目为________________。
![]() 某同学分析发现D装置有两处缺陷,分别是_____________、________________。
某同学分析发现D装置有两处缺陷,分别是_____________、________________。
![]() 设计实验提纯产品:_________________________________________________________。
设计实验提纯产品:_________________________________________________________。
![]() 测定产品纯度。
测定产品纯度。
步骤Ⅰ:称取1.20g样品![]() 杂质不含
杂质不含![]() 于烧瓶中,加入
于烧瓶中,加入![]() 氢氧化钠溶液共热,冷却至室温。加入
氢氧化钠溶液共热,冷却至室温。加入![]() 硝酸,一段时间后,将烧瓶中的溶液全部转移至
硝酸,一段时间后,将烧瓶中的溶液全部转移至![]() 容量瓶中,加水定容
容量瓶中,加水定容![]() 溶液中为乳酸和
溶液中为乳酸和![]() 。
。
步骤Ⅱ:从容量瓶中各取![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 作指示剂,用
作指示剂,用![]() 溶液分别滴定溶液中的
溶液分别滴定溶液中的![]() 已知:
已知:![]() 为砖红色沉淀、乳酸银不沉淀
为砖红色沉淀、乳酸银不沉淀![]() ,平行三次实验,所得滴定数据如表所示:
,平行三次实验,所得滴定数据如表所示:
实验序号 实验数据 | 第一次 | 第二次 | 第三次 | |
| 滴定前 | 0 |
|
|
滴定后 |
|
|
| |
![]() 加入硝酸的目的是_______________________________________。
加入硝酸的目的是_______________________________________。
![]() 步骤Ⅱ操作中,达到滴定终点的现象是___________________________________________。
步骤Ⅱ操作中,达到滴定终点的现象是___________________________________________。
![]() 样品中
样品中![]() 氯丙酸的质量分数为__________
氯丙酸的质量分数为__________![]() 保留三位有效数字
保留三位有效数字![]() 。
。
【题目】下列由实验得出的结论正确的是( )
选项 | 实验操作及现象 | 结论 |
A | 甲烷与氯气以体枳比1:1混合在光照下反应生成油状物质 | 油状物质为一氯甲烷 |
B | 将苯加入溴水中,振荡,溴水层为无色 | 苯与Br2发生了加成反应 |
C | 碳酸钠溶液中加入乙酸产生气泡 | 乙酸酸性强于碳酸 |
D | 加热乙醇、冰醋酸及浓硫酸的混合液,有果香味物质生成 | 乙醇与冰醋酸发生了加成反应 |
A.AB.BC.CD.D