题目内容
【题目】![]() 氯丙酸
氯丙酸![]() 主要用于生产农药除草剂,还用于生产乳酸及有工业价值的低级醇酯。如图为实验室制备
主要用于生产农药除草剂,还用于生产乳酸及有工业价值的低级醇酯。如图为实验室制备![]() 氯丙酸的装置。
氯丙酸的装置。
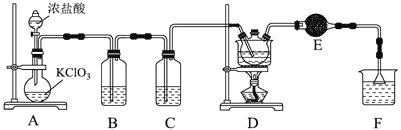
已知:相关物质的物理性质如下表所示:
物质 | 熔点 | 沸点 | 溶解性 |
| 14 | 190 | 能与水、乙醇互溶 |
丙酸 |
| 141 | 能与水、乙醇互溶 |
|
|
| 与水剧烈反应,能溶于乙醇 |
制备方法:在三颈烧瓶中放置![]() 丙酸和
丙酸和![]() 三氯化磷
三氯化磷![]() 作催化剂
作催化剂![]() ,加热至
,加热至![]() ,缓慢通入氯气,保持温度在
,缓慢通入氯气,保持温度在![]() 之间大约反应
之间大约反应![]() 。
。
回答下列问题:
![]() 装置中反应的离子方程式为_____________________________________________,当生成
装置中反应的离子方程式为_____________________________________________,当生成![]() (标准状况)时,转移电子的数目为________________。
(标准状况)时,转移电子的数目为________________。
![]() 某同学分析发现D装置有两处缺陷,分别是_____________、________________。
某同学分析发现D装置有两处缺陷,分别是_____________、________________。
![]() 设计实验提纯产品:_________________________________________________________。
设计实验提纯产品:_________________________________________________________。
![]() 测定产品纯度。
测定产品纯度。
步骤Ⅰ:称取1.20g样品![]() 杂质不含
杂质不含![]() 于烧瓶中,加入
于烧瓶中,加入![]() 氢氧化钠溶液共热,冷却至室温。加入
氢氧化钠溶液共热,冷却至室温。加入![]() 硝酸,一段时间后,将烧瓶中的溶液全部转移至
硝酸,一段时间后,将烧瓶中的溶液全部转移至![]() 容量瓶中,加水定容
容量瓶中,加水定容![]() 溶液中为乳酸和
溶液中为乳酸和![]() 。
。
步骤Ⅱ:从容量瓶中各取![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 作指示剂,用
作指示剂,用![]() 溶液分别滴定溶液中的
溶液分别滴定溶液中的![]() 已知:
已知:![]() 为砖红色沉淀、乳酸银不沉淀
为砖红色沉淀、乳酸银不沉淀![]() ,平行三次实验,所得滴定数据如表所示:
,平行三次实验,所得滴定数据如表所示:
实验序号 实验数据 | 第一次 | 第二次 | 第三次 | |
| 滴定前 | 0 |
|
|
滴定后 |
|
|
| |
![]() 加入硝酸的目的是_______________________________________。
加入硝酸的目的是_______________________________________。
![]() 步骤Ⅱ操作中,达到滴定终点的现象是___________________________________________。
步骤Ⅱ操作中,达到滴定终点的现象是___________________________________________。
![]() 样品中
样品中![]() 氯丙酸的质量分数为__________
氯丙酸的质量分数为__________![]() 保留三位有效数字
保留三位有效数字![]() 。
。
【答案】![]()
![]() 或
或![]() 缺少温度计 应该用冷凝管对反应液冷凝回流,提高反应物的利用率 将产品移至蒸馏烧瓶中,蒸去少量的前馏分后,收集
缺少温度计 应该用冷凝管对反应液冷凝回流,提高反应物的利用率 将产品移至蒸馏烧瓶中,蒸去少量的前馏分后,收集![]() 的馏分,冷凝得到
的馏分,冷凝得到![]() 氯丙酸
氯丙酸 ![]() 中和NaOH使溶液呈酸性,防止
中和NaOH使溶液呈酸性,防止![]() 干扰 当滴入最后一滴
干扰 当滴入最后一滴![]() 溶液时,产生砖红色沉淀,且30s内沉淀不消失
溶液时,产生砖红色沉淀,且30s内沉淀不消失 ![]() 。
。
【解析】
浓盐酸和KClO3反应生成Cl2,制取的氯气中含有HCl和H2O杂质气体,需要除去,利用饱和食盐水除去HCl,在用浓硫酸干燥,因此B、C中分别为饱和食盐水、浓硫酸;由于PCl3与水剧烈反应,因此要防止外界的水蒸气进入,E为干燥管,防止外界的水蒸气进入D,最后F为尾气处理装置。
![]() 中浓盐酸和氯酸钾反应生成氯气,根据离子反应方程式
中浓盐酸和氯酸钾反应生成氯气,根据离子反应方程式![]() ,反应中生成
,反应中生成![]() 时转移5mol电子,因此生成
时转移5mol电子,因此生成![]() 时,转移
时,转移![]() 电子;
电子;
故答案为:![]() ,
,![]() 或
或![]() ;
;
![]() 根据信息反应需要加热,缺少温度计,有机物易挥发,应该用冷凝管对反应液冷凝回流,提高反应物的利用率;
根据信息反应需要加热,缺少温度计,有机物易挥发,应该用冷凝管对反应液冷凝回流,提高反应物的利用率;
故答案为:缺少温度计;应该用冷凝管对反应液冷凝回流,提高反应物的利用率;
![]() 根据信息,三颈烧瓶中有丙酸和
根据信息,三颈烧瓶中有丙酸和![]() 氯丙酸混合有机物,可以利用沸点不同进行蒸馏提纯;
氯丙酸混合有机物,可以利用沸点不同进行蒸馏提纯;
故答案为:将产品移至蒸馏烧瓶中,蒸去少量的前馏分后,收集![]() 的馏分,冷凝得到
的馏分,冷凝得到![]() 氯丙酸;
氯丙酸;
![]() 氯丙酸碱性条件下水解得到氯离子,再用硝酸银滴定,但是残留的氢氧根离子有干扰,故加硝酸排除干扰;
氯丙酸碱性条件下水解得到氯离子,再用硝酸银滴定,但是残留的氢氧根离子有干扰,故加硝酸排除干扰;
故答案为:中和NaOH使溶液呈酸性,防止img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/01/9c3afa82/SYS202011270110064921819321_DA/SYS202011270110064921819321_DA.007.png" width="38" height="19" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />干扰;
![]() 滴定终点前是氯化银白色沉淀,终点后有砖红色铬酸银生成,
滴定终点前是氯化银白色沉淀,终点后有砖红色铬酸银生成,
故答案为:当滴入最后一滴![]() 溶液时,产生砖红色沉淀,且30s内沉淀不消失;
溶液时,产生砖红色沉淀,且30s内沉淀不消失;
![]() 第二组数据误差较大舍去,余下两组取平均值得
第二组数据误差较大舍去,余下两组取平均值得![]() ,根据关系式
,根据关系式![]() 可知,样品中
可知,样品中![]() 氯丙酸的质量m=nM=cVM=0.01L×0.2000mol·L-1×108.5g·mol-1×5=1.085g,则质量分数为
氯丙酸的质量m=nM=cVM=0.01L×0.2000mol·L-1×108.5g·mol-1×5=1.085g,则质量分数为![]() ×100%≈90.4%,
×100%≈90.4%,
故答案为:![]() 。
。

【题目】氯化亚铜是一种重要的化工原料,一种利用低品位铜矿![]() 主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等
主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等![]() 为原料制取CuCl的工艺流程如下:
为原料制取CuCl的工艺流程如下:

(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________________________;
(2)滤渣Ⅰ的成分除S和![]() 外还含有___________,反应 Ⅰ中
外还含有___________,反应 Ⅰ中![]() 的作用为_______________
的作用为_______________
(3)已知生成氢氧化物的pH如下表,则反应Ⅱ“中和”时,用氨水调pH的范围是______________。
物质 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
(4)检验滤液Ⅱ中是否含有![]() 所需要的试剂是:______________
所需要的试剂是:______________
(5)①反应Ⅲ中生成难溶![]() 的离子方程式:______________
的离子方程式:______________
②反应Ⅳ所对应的化学方程式:______________________________
(6) CuCl的定量分析
步骤1.取样品0.7500g和30.0mL 1.0mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000mol·L-1 Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如下表
序号 | 1 | 2 | 3 |
起始读数 |
|
|
|
终点读数 |
|
|
|
已知:![]() ;
;![]() 。
。
①数据处理:计算得CuCl的纯度为_________![]()
②误差下列操作会使测定结果偏高的是______________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.用量筒取10.0mL 1.0mol·L-1的![]() 溶液时仰视刻度线
溶液时仰视刻度线
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;常温下H2C2O4为晶体,易溶于水,溶解度随温度升高而增大。

请回答:
(1)步骤②,发生反应的离子方程式____________________________;该步骤H2C2O4稍过量主要是为了_________________。
(2)下列操作或描述正确的是_______________。
A.步骤①,酸化主要是为了抑制Fe2+水解
B.步骤③,如果采用冷水洗涤可提高除杂效果
C.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n(Fe2+)/mol | n(C2O42-)·mol-1 | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.98 |
由表中数据推测试样中最主要的杂质是_________________。
(4)实现步骤④必须用到的两种仪器是_________(供选仪器如下)
a.坩埚;b.烧杯;c.蒸馏烧瓶;d.锥形瓶;e.表面皿:f.高温炉
该步骤的化学方程式是______________________________________________。
【题目】工业上利用电解饱和食盐水来制取烧碱,所用的食盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.用盐酸调节滤液的pH,获得一次精制盐水。
(1)过程Ⅰ中除去的离子是______。
(2)表是过程Ⅰ、Ⅱ中生成的部分沉淀及其在20℃时的溶解度(g/100 gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
运用表中信息回答下列问题:
①过程Ⅱ中生成的主要沉淀除CaCO3和Mg2(OH)2CO3外还有______。
②过程Ⅰ选用的是BaCl2而不选用CaCl2,原因是______。
③除去Mg2+的离子方程式是______。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是______。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意图如图:
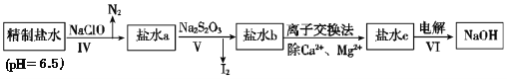
①过程Ⅳ除去的离子是______。
②盐水b中含有SO42-,Na2S2O3将IO3-还原为I2的离子方程式是______。
③在过程Ⅴ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配制成250.0 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500 mol/L的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),滴定达到终点时的现象是______。下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
计算样品的纯度为______。
【题目】短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,回答下列问题:
A | B | |
C | D |
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1 mol气态氢化物对应的热量变化如下,其中能表示该主族第四周期元素的单质生成1 mol气态氢化物所对应的热量变化是______![]() 选填字母编号
选填字母编号![]() 。
。
![]() 吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。
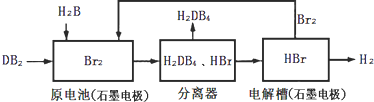
①查得:
化学键 | H-H | Br-Br | H-Br |
键能(kJ/mol) | 436 | 194 | 362 |
试写出通常条件下电解槽中发生总反应的热化学方程式:______。
②根据资料:
化学式 | Ag2SO4 | AgBr |
溶解度(g) | 0.796 | 8.4×10-6 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到______,证明分离效果较好。
③在原电池中,负极发生的反应式为______。
④在电解过程中,电解槽阴极附近溶液pH______(填“变大”、“变小”或“不变”)。
⑤将该工艺流程用总反应的化学方程式表示为:________,该生产工艺的优点有_____(答一点即可);缺点有____(答一点即可)。
(3)溴及化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入______,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为______。
(4)CuBr2分解的热化学方程式为:2CuBr2(s)![]() 2CuBr(s)+Br2(g)△H=+105.4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
2CuBr(s)+Br2(g)△H=+105.4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会______(填“增大”“不变”“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为______。




