��Ŀ����
����Ŀ������ͼ�����ý�����ȷ����

A.ͼ���Ƿ�Ӧ2SO2(g)��O2(g) ![]() 2SO3(g) ��H��0��SO2��ƽ��ת�������¶ȡ�ѹǿ�ı仯���ߣ�˵��X�����¶ȣ�Y����ѹǿ����Y1��Y2
2SO3(g) ��H��0��SO2��ƽ��ת�������¶ȡ�ѹǿ�ı仯���ߣ�˵��X�����¶ȣ�Y����ѹǿ����Y1��Y2
B.ͼ������������0.1000 mol��L��1��һԪ��HA�ζ�20.00 mL 0.1000 mol��L��1��һԪ��BOH�ĵζ����ߣ�˵��BOH��ǿ��
C.ͼ����������ϡ�ͱ�����ʱ��Һ�ĵ������������ˮ������ı仯���ߣ�˵������ĵ���̶ȣ�b��a��c
D.ͼ����������ϡ����ͬ�������ͬpH��ϡ�����ϡ����ʱ��Һ��pH�����ˮ������ı仯���ߣ�˵������M������������
���𰸡�AD
��������
A. ����ѹǿ��ƽ���������С�ķ����ƶ�����ƽ�������ƶ���SO2��ƽ��ת��������
B. ���ﵽ�ζ��յ�ʱ��Һ��pHΪ6����Һ�����ԣ�˵������ǿ�������Σ�
C. ��ˮ�ٽ�����ĵ��룬��ҺԽϡ������̶�Խ��
D. ǿ�������ϡ��ʱ��ǿ���pH�ı仯���������pH�ı仯��
A. ����ѹǿ��ƽ�������ƶ���SO2��ƽ��ת�����������Y1��Y2��A����ȷ��
B. ���ﵽ�ζ��յ�ʱ��Һ��pHΪ6����Һ�����ԣ�˵������ǿ�������Σ����BOH�����B�����
C. ��ˮ�ٽ�����ĵ��룬��ҺԽϡ������̶�Խ��a��b��c�������ˮ�����c ��b��a����˵���̶�c ��b��a��C�����
D. ǿ�������ϡ��ʱ��ǿ���pH�ı仯���������pH�ı仯�����ϡ����ͬ�������ͬpH��ϡ�����ϡ����ʱ������M�����������ᣬ����NΪ���ᣬD����ȷ��
��ѡAD��

 ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д� ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�����Ŀ��ij��ȤС���Է���м�Ƶ���������狀����������Ʊ���ˮ�ϲ�������(FeC2O4��2H2O)����һ���Ʊ��ߴ��Ȼ�ԭ���ۡ�
��֪��FeC2O4��2H2O������ˮ��150�濪ʼʧ�ᾧˮ��������H2C2O4Ϊ���壬������ˮ���ܽ�����¶����߶�����

��ش�
��1������ڣ�������Ӧ�����ӷ���ʽ____________________________���ò���H2C2O4�Թ�����Ҫ��Ϊ��_________________��
��2�����в�����������ȷ����_______________��
A������٣��ữ��Ҫ��Ϊ������Fe2+ˮ��
B������ۣ����������ˮϴ�ӿ���߳���Ч��
C������ۣ�����ڳ�ѹ�¿��ٸ���¶ȿ�ѡ���Ը���100��
��3����ȡһ������FeC2O4��2H2O�������������ܽ⣬����KMnO4�ζ����ⶨ�����������£�
n(Fe2��)/mol | n(C2O42��)��mol��1 | ������FeC2O4��2H2O���������� |
9.80��10��4 | 9.80��10��4 | 0.98 |
�ɱ��������Ʋ�����������Ҫ��������_________________��
��4��ʵ�ֲ���ܱ����õ�������������_________(��ѡ��������)
a��������b���ձ���c��������ƿ��d����ƿ��e��������f������¯
�ò���Ļ�ѧ����ʽ��______________________________________________��
����Ŀ��������Ԫ��A��B��C��D�����ڱ��е�λ����ͼ��ʾ��B��D����������֮��Ϊ12���ش��������⣺
A | B | |
C | D |
(1)��Ԫ��B��D����ͬһ����ĵ�2-5����Ԫ�ص��ʷֱ���H2��Ӧ����1 mol��̬�⻯���Ӧ�������仯���£������ܱ�ʾ�������������Ԫ�صĵ�������1 mol��̬�⻯������Ӧ�������仯��______![]() ѡ����ĸ���
ѡ����ĸ���![]() ��
��
![]() ����99.7kJ b.����29.7kJ c.�ų�20.6kJ d.�ų�241.8kJ
����99.7kJ b.����29.7kJ c.�ų�20.6kJ d.�ų�241.8kJ
(2)DB2ͨ�����й������̿��ƻ���ҵԭ��H2DB4�������ԴH2��
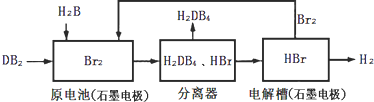
�ٲ�ã�
��ѧ�� | H-H | Br-Br | H-Br |
����(kJ/mol) | 436 | 194 | 362 |
��д��ͨ�������µ����з����ܷ�Ӧ���Ȼ�ѧ����ʽ��______��
�ڸ������ϣ�
��ѧʽ | Ag2SO4 | AgBr |
�ܽ��(g) | 0.796 | 8.4��10-6 |
Ϊ����������ķ���Ч����ȡ������H2DB4��Һ���Թܣ���������μ���AgNO3��Һ����ַ�Ӧ�����۲쵽______��֤������Ч���Ϻá�
����ԭ����У����������ķ�ӦʽΪ______��
���ڵ������У���������������ҺpH______(���������������С������������)��
�ݽ��ù����������ܷ�Ӧ�Ļ�ѧ����ʽ��ʾΪ��________�����������յ��ŵ���_____(��һ�㼴��)��ȱ����____(��һ�㼴��)��
(3)�弰������㷺Ӧ����ҽҩ��ũҩ����ά��������ȼ���ȣ��ش��������⣺��ˮ��������У���Ũ���ĺ�ˮ��ͨ��______�������е�Br-���������ÿ��������壻Ȼ����̼������Һ�����壬���绯ΪBr-��BrO3-�������ӷ���ʽΪ______��
(4)CuBr2�ֽ���Ȼ�ѧ����ʽΪ��2CuBr2(s)![]() 2CuBr(s)+Br2(g)��H=+105.4kJ/mol�����ܱ������н�����CuBr2��487K�¼��ȷֽ⣬ƽ��ʱp(Br2)Ϊ4.66��103Pa��
2CuBr(s)+Br2(g)��H=+105.4kJ/mol�����ܱ������н�����CuBr2��487K�¼��ȷֽ⣬ƽ��ʱp(Br2)Ϊ4.66��103Pa��
���練Ӧ��ϵ��������䣬��߷�Ӧ�¶ȣ���p(Br2)����______(����������������������С��)��
���練Ӧ�¶Ȳ��䣬����Ӧ��ϵ���������һ������p(Br2)�ı仯��ΧΪ______��
����Ŀ����һ���¶��£�10mL0.40mol/L H2O2�������ֽ⡣��ͬʱ�̲ⶨ����O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ���Һ����仯���Բ��ƣ�
A��0~6min��ƽ����Ӧ���ʣ�v��H2O2��![]()
![]() mol/(L��min)
mol/(L��min)
B��6~10min��ƽ����Ӧ���ʣ�v��H2O2����![]() mol/(L��min)
mol/(L��min)
C����Ӧ��6minʱ��c��H2O2��=0.3mol/L
D����Ӧ��6minʱ��H2O2�ֽ���50%




