题目内容
【题目】Fe、Si金属间化合物是近几年研究的热点材料,它在电子学、热电、光电和磁学等领域有着广泛的应用,另外铁的配合物也有极其广泛的用途。回答下列问题:
(1)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,其中Htrz为1,2,4–三氮唑( )。
)。
①配合物中阴离子空间构型为________,中心原子的杂化方式是________。
②Htrz分子中含σ键数为______个,其与Fe2+形成配位键的原子是_______。
③1,2,4–三氮唑与环戊二烯(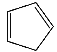 )的物理性质如下:
)的物理性质如下:
环戊二烯 | 1,2,4–三氮唑 | |
相对分子质量 | 66 | 69 |
物理性质 | 无色液体,不溶于水,沸点为42.5℃ | 无色晶体,溶于水,沸点为260℃ |
它们的水溶性和沸点差异很大的主要原因是________________________。
(2)一种Fe、Si金属间化合物的晶胞结构如下图所示:
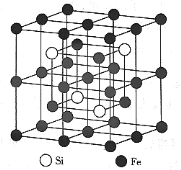
晶胞中含铁原子为_____个,已知晶胞参数为0.564nm,阿伏加德罗常数的值为NA,则Fe、Si金属间化合物的密度为___________g·cm–3(列出计算式)
【答案】正四面体型 sp3 8 N 1,2,4–三氮唑分子间、与水分子间都可以形成氢键 12 ![]()
【解析】
根据价层电子对互斥模型分析微粒空间构型及轨道杂化类型;根据配体的结构判断σ键数目;根据氢键对物质物理性质的影响分析;根据晶胞结构计算晶胞密度。
(1)①ClO4-的价电子对数为(7+1)/2=4,Cl原子上没有孤电子对,空间构型为正四面体型,Cl原子采用sp3杂化;
② 环上有5个σ键,环外有3个σ键,共8个σ键;Htrz分子中只有N原子有孤电子对,H、C无孤对电子,所以与Fe2+形成配位键的原子是N;
环上有5个σ键,环外有3个σ键,共8个σ键;Htrz分子中只有N原子有孤电子对,H、C无孤对电子,所以与Fe2+形成配位键的原子是N;
③两者结构相似,相对分子质量非常接近,但Htrz分子中有N-H键,N原子半径小,电负性大,分子间可以形成氢键,也可以与水分子间形成氢键,所以它们的水溶性和沸点差异很大的主要原因是:1,2,4–三氮唑分子间、与水分子间都可以形成氢键;
(2)Fe在顶点有8个,面心有6个,棱上有12个,体内有4个,体心有1个,共含8×1/8+6×1/2+12×1/4+4+1=12个,N原子有4个,晶胞的质量m=(12×56+4×28)/NAg,体积为V=(0.564×10-7)3cm3,ρ=m/V=![]() g/cm3。
g/cm3。






