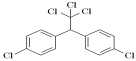
题目内容
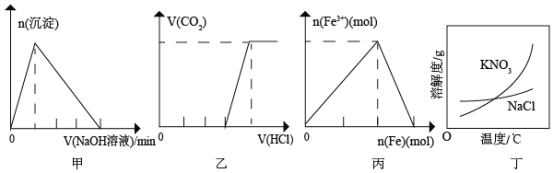
【题目】将一定质量的Mg和Al混合物投入到200 mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法错误的是
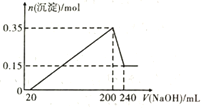
A.最初20 mL NaOH溶液用于中和过量的稀硫酸
B.NaOH溶液物质的量浓度为![]()
C.Mg和Al的总质量为9g
D.生成的氢气在标准状况下的体积为11.2 L
【答案】D
【解析】
由图象可以知道,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:![]() .当V(NaOH溶液)=200mL时,沉淀量最大,此时为
.当V(NaOH溶液)=200mL时,沉淀量最大,此时为![]() 和
和![]() ,二者物质的量之和为0.35mol,溶液中溶质为
,二者物质的量之和为0.35mol,溶液中溶质为![]() ,根据钠元素守恒可以知道此时
,根据钠元素守恒可以知道此时![]() 等于200mL氢氧化钠溶液中含有的n(NaOH)的0.5倍.从200mL到240mL,NaOH溶解
等于200mL氢氧化钠溶液中含有的n(NaOH)的0.5倍.从200mL到240mL,NaOH溶解![]() ,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为
,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为![]() ,物质的量为0.15mol,
,物质的量为0.15mol, ![]() 为0.15mol,
为0.15mol, ![]() 为0.35mol-0.15mol=0.2mol,因为从200mL到240mL,发生
为0.35mol-0.15mol=0.2mol,因为从200mL到240mL,发生![]() ,所以该阶段消耗
,所以该阶段消耗![]() ,氢氧化钠的浓度为
,氢氧化钠的浓度为![]() .
.
A. 由上述分析可以知道,最初20mLNaOH溶液用于中和过量的稀硫酸,所以A选项是正确的;
B. 由上述分析可以知道,氢氧化钠溶液的物质的量浓度为5mol/L,所以B选项是正确的;
C. 由元素守恒可以知道![]() ,
,![]() ,所以镁和铝的总质量为
,所以镁和铝的总质量为![]() ,所以C选项是正确的;
,所以C选项是正确的;
D. 由电子守恒可以知道,生成的氢气为![]() ,若在标况下,体积为
,若在标况下,体积为![]() ,但状况未知,故D错误;
,但状况未知,故D错误;
故答案选D。

【题目】Fe、Si金属间化合物是近几年研究的热点材料,它在电子学、热电、光电和磁学等领域有着广泛的应用,另外铁的配合物也有极其广泛的用途。回答下列问题:
(1)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,其中Htrz为1,2,4–三氮唑(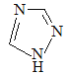 )。
)。
①配合物中阴离子空间构型为________,中心原子的杂化方式是________。
②Htrz分子中含σ键数为______个,其与Fe2+形成配位键的原子是_______。
③1,2,4–三氮唑与环戊二烯(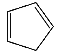 )的物理性质如下:
)的物理性质如下:
环戊二烯 | 1,2,4–三氮唑 | |
相对分子质量 | 66 | 69 |
物理性质 | 无色液体,不溶于水,沸点为42.5℃ | 无色晶体,溶于水,沸点为260℃ |
它们的水溶性和沸点差异很大的主要原因是________________________。
(2)一种Fe、Si金属间化合物的晶胞结构如下图所示:

晶胞中含铁原子为_____个,已知晶胞参数为0.564nm,阿伏加德罗常数的值为NA,则Fe、Si金属间化合物的密度为___________g·cm–3(列出计算式)