题目内容
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务。下列有关海水综合利用的说法不正确的是( )
A.从海水中提炼出的氘(含HDO 0.03‰)进行核聚变,放出巨大的能量以解决能源问题,成为一条新的科学思路,HDO与H2O化学性质相同
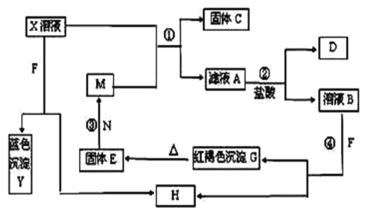
B.从海水中提取镁可以采用下列方法:海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2·6H2O
MgCl2溶液→MgCl2·6H2O![]() MgCl2(熔融)
MgCl2(熔融)![]() Mg[
Mg[
C.从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是I4O9
D.除去粗盐中的SO42 -、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
【答案】D
【解析】
A、同位素是质子数相同,中子数不同的同种元素的不同原子,原子最外层电子数相同,化学性质相同,HDO与H2O化学性质相同,故A正确;
B、海水中含有镁离子,先将海水蒸发、浓缩得到含有镁离子的溶液,再向溶液中加入沉淀剂将Mg 2+转化为Mg(OH)2,加入的沉淀剂应该具有碱性且价格较廉价、来源丰富,贝壳中含有CaCO3且来源丰富,煅烧贝壳得到CaO,将CaO溶于水得到Ca(OH)2,所以加入的沉淀剂是Ca(OH)2,将镁离子转化为Mg(OH)2;将Mg(OH)2溶于稀盐酸得到MgCl2,将MgCl2在HCl氛围中加热得到MgCl2固体,电解熔融MgCl2得到Mg,MgCl2(熔融)![]() Mg+Cl2↑,故B正确;
Mg+Cl2↑,故B正确;
C、因碘酸碘的化学式一定为Im(IO3)n形式,其中碘酸根为-1价(类似于氯酸根),碘酸根中I的化合价为+5价,所以前面的I的化合价为+3价,所以碘酸碘的化学式为:I(IO3)3,即 I4O9,故C正确;
D、除去粗盐中的可溶性杂质:Mg2+、Ca2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓,加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序;然后调节溶液的pH等于7后蒸发即可,选项中过量的氯化钡不能除去,故D错误;
故选D。
【点晴】
本题主要考查同位素概念和性质的分析判断,海水中提取镁的过程,知道每一步发生的反应及操作方法,再结合物质的性质、金属冶炼方法的选取等知识点,粗盐提纯的实验方法应用,化合价的规律和原则,同时还考查常见元素及原子团的化合价,解题应抓住题目信息。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】Fe、Si金属间化合物是近几年研究的热点材料,它在电子学、热电、光电和磁学等领域有着广泛的应用,另外铁的配合物也有极其广泛的用途。回答下列问题:
(1)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,其中Htrz为1,2,4–三氮唑(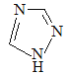 )。
)。
①配合物中阴离子空间构型为________,中心原子的杂化方式是________。
②Htrz分子中含σ键数为______个,其与Fe2+形成配位键的原子是_______。
③1,2,4–三氮唑与环戊二烯(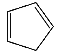 )的物理性质如下:
)的物理性质如下:
环戊二烯 | 1,2,4–三氮唑 | |
相对分子质量 | 66 | 69 |
物理性质 | 无色液体,不溶于水,沸点为42.5℃ | 无色晶体,溶于水,沸点为260℃ |
它们的水溶性和沸点差异很大的主要原因是________________________。
(2)一种Fe、Si金属间化合物的晶胞结构如下图所示:

晶胞中含铁原子为_____个,已知晶胞参数为0.564nm,阿伏加德罗常数的值为NA,则Fe、Si金属间化合物的密度为___________g·cm–3(列出计算式)